ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Показания к операции.Сложность техники операции на берцовых артериях диаметром 1,5—3 мм, нередкие осложнения и ухудшение состояния конечности по сравнению с дооперационным в случае раннего тромбоза или глубокого нагноения раны, высокий процент поздних тромбозов шунтов являются обоснованием точки зрения большинства хирургов, что такие операции показаны только в случае тяжелой ишемии конечности при реальной угрозе ампутации. 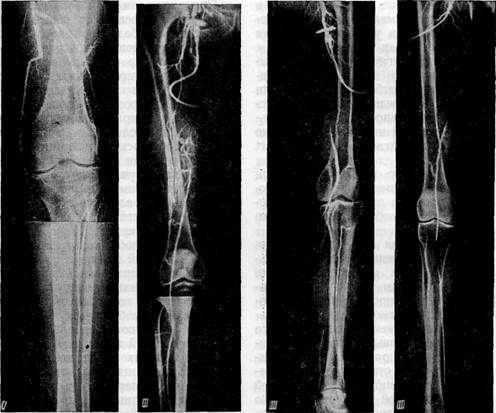
'Рис. 112.Артериограммы больных с различными типами окклюзии подколенно-берцово-
го сегмента
Подобные вмешательства получили название «операции, спасающие конечность» («operation for limb sol-vage»). Мы считаем, что операция показана также больным с резко выраженной перемежающейся хромотой в случае неэффективного терапевтического лечения.
Хотя подобные операции обычно длятся 3—5 ч, они не относятся к группе травматичных. Применяют общее обезболивание, нейролептанал-гезию и перидуральную анестезию. При определении показаний следует учитывать, что операционная летальность после восстановительных операций относительно низкая — до 1— 4%, в то время как после высоких ампутаций конечности у больных вследствие неэффективности терапев-
тического лечения она достигает 20— 30%. Решающими при определении показаний к хирургическому лечению чаще являются не факторы риска операции, а местные условия опера-бел ьности.
Для успеха реконструктивных операций на артериях голени существенное значение имеют два условия: 1) сохранение проходимости по крайней мере 1 из 3 берцовых артерий в дис-тальном отделе голени и на стопе, чтобы обеспечить адекватные условия оттока; 2) удовлетворительные условия притока крови по подвздошным и бедренной артериям.
Как показали клинические наблюдения (Alemany, 1973, и др.), окклюзия артерий голени у значительного числа больных является сег- ментарнои, чаще с вовлечением в процесс проксимальной части берцовых артерий до уровня отхождения крупных боковых ветвей.
Серийная ангиография самого высокого качества является необходимым условием отбора пациентов для операции и определения местных условий операбельности. Каждому больному с тяжелой ишемией необходимо производить ангиографию (Reichart с соавт., 1974).
Ангиографию не применяют при необратимых изменениях тканей стопы и голени или при общих противопоказаниях к любым восстановительным операциям.
Выбор метода хирургического лечения. Применение восстановительных сосудистых операций возможно главным образом у больных с поражениями I и II типов. При безуспешности терапевтического лечения у больных с наличием неоперабельного поражения главным образом III типа, показана поясничная симпатэк-томия, при IV стадии ишемии — нередко в сочетании с катетеризацией ветвей бедренной артерии с целью длительной внутриартериальной ин-фузионной терапии, а также экономная ампутация.
Тромбэндартериэктомию как самостоятельный вид реконструкции при этих окклюзионных поражениях применяют редко. Однако в сочетании с обходным шунтированием веной, как дополнительное вмешательство, мы производим открытую тромбэндартери-эктомию из подколенной артерии и тибио-фибулярного ствола у некоторых больных с окклюзией I типа.
Основным методом артериальной реконструкции при окклюзии под-коленно-голено-стопного сегмента является обходное шунтирование ауто-веной от бедренной (общей или поверхностной) до подколенной артерии, тибио-фибулярного ствола (длинное шунтирование) или к отдельным берцовым артериям в средней и нижней третях голени (сверхдлинное шунтирование).
При окклюзии I типа применяют шунтирование веной от общей или поверхностной бедренной артерии к отдельным берцовым артериям, сохранившим просвет, с использованием доступов к артериям в верхней и средней третях голени. Отдают предпочтение шунтированию задней боль-шеберцовой артерии при условии сохранения проходимости дистальной ее части. Реваскуляризация малоберцовой артерии может быть оправдана только в случае облитерации обеих большеберцовых артерий при наличии коллатералей к сосудистому бассейну передней или задней боль-шеберцовой артерии.
При II типе облитерирующих поражений артерий голени в сочетании с окклюзией поверхностной бедренной артерии применяют, как правило, шунтирование к подколенной артерии или к тибио-фибулярному стволу, которые выделяют медиальным доступом в верхней трети голени. У некоторых больных дополнительно выполняют Тромбэндартериэктомию из подколенной артерии.
Как и большинство хирургов, мы считаем целесообразным сочетать операции реваскуляризации артерий голени с поясничной преганглнонарной симпатэктомией на стороне поражения сосудов. Симпатэктомию выполняем обычно одновременно с реконструктивной операцией. Bartos (1970), Lee с соавторами (1973) и другие производят симпатэктомию за 2 нед до сосудистой операции.
По вопросу о целесообразности выполнения дополнительной симпат-эктомии нет единой точки зрения. Так, Tyson и Reichle (1972), хотя и применили симпатэктомию у 1/4 части больных, считают, что эта операция не улучшает результатов обходного бедренно-берцового шунтирования. Tyson (1969), Buda с соавторами (1977) не находят существенной разницы в результатах лечения больных, у которых выполняли и не применяли симпатэктомию. По мнению Dale (1969), симпатэктомия не обязатель- на, главное — выполнить технически совершенно дистальный анастомоз.
По данным Lee с соавторами (1973), основанным на измерении кровотока в шунте во время операции с помощью электромагнитной флоуметрии, сразу после выполнения симпатэктомии у большинства больных кровоток возрастает. Особенно это выражено у больных молодого возраста. Если этот эффект связан (Lee с соавт., 1973, и др.) главным образом с открытием артерио-венозных шунтов без определенного увеличения кровотока в капиллярах, в любом случае увеличение кровотока в шунте имеет положительное значение, так как уменьшается опасность его тромбоза. Некоторые авторы отмечают положительное влияние поясничной симпатэктомии на заживление язвенно-некротических изменений кожи стопы. Таким образом, есть основания считать поясничную симпатэктомию ценным дополнением к реконструктивным операциям на сосудах голени. Сочетание сосудистой пластической операции и симпатэктомии особенно показано при энд-артериите у больных сравнительно молодого возраста.
При сочетанных окклюзиях магистральных артерий таза и голени (тип АС) рекомендуется сочетание реконструктивной операции на аорто-подвздошном сегменте с поясничной симпатэктомией (Vollmar, Laubach, 1966). Аналогичная тактика при сочетанных трехсегментарных окклюзиях (тип ABC). У отдельных больных по специальным показаниям может быть выполнена одно- или двух-этапная двойная реконструкция — восстановление аорто-подвздошного сегмента и бедренно-подколенное или бедренно-берцовое аутовенозное шунтирование.
Поскольку при распространенном облитерирующем поражении артерий бедренно-подколенно-голено-стопного сегмента нередко вовлекаются в процесс устье, начальный отдел и значительная часть основного ствола глубокой бедренной артерии, восстанов-
ление кровотока в ней (профундо-пластика) улучшает коллатеральное кровоснабжение и способствует заживлению язв и некрозов стопы (Lin-ton и Widle, 1970; Conn с соавт., 1971, и др.). Профундопластику осуществляют как основную и самостоятельную операцию или в сочетании с реконструкцией бедренно-под-коленно-берцового сегмента.
У некоторых больных с диффузным поражением сосудов голени, общими противопоказаниями к операции, при отсутствии венозного трансплантата соответствующей длины для бедренно-подколенно-берцового шунтирования реконструкция глубокой бедренной артерии является единственным вмешательством, которое может быть выполнено. В таком случае операцию рассматривают как альтернативу бедренно-подколенного шунтирования, позволяющую у значительной части больных сохранить конечность от ампутации. У больных с высоким риском операции вмешательство на глубокой артерии бедра может быть выполнено под местной анестезией. Martin с соавторами (1972), Tschirkov с соавторами (1977) считают, что профундопластика имеет преимущество перед реконструкцией бедренно-подколенного сегмента, так как магистральные — проводящие артерии (эластического типа) в последующем могут быстро поражаться атеросклерозом, в то время как глубокая артерия бедра, относящаяся к питающим артериям мышечного типа (как почечные, брыжеечные и другие), обычно в меньшей степени поражается атеросклеротическим процессом (Crawford с соавт., 1960, и др.)- Если же в глубокой артерии бедра и бывают атеросклеротические изменения (примерно у 12—14% больных), то они обычно локализуются в начальном ее отделе (примерно у 74% больных; Tschirkov с соавт., 1977).
В настоящее время доказано (Leeds, Gilfillan, 1961; Morris с соавт., 1961; Martin с соавт., 1970; Kiely с соавт., 1973, и др.) большое значение глубо- кой артерии бедра как основной коллатеральной системы при окклюзии поверхностной бедренной артерии («естественный бедренно-подколенный шунт», Dunlop, 1970).
Стенотические поражения глубокой артерии бедра, которые часто не диагностируются при обычной методике артериографии, нередко являются причиной развития клинических признаков тяжелой ишемии конечности (III, IV степени) у больных с окклюзией бедренно-подколенно-берновой области. В таком случае устранение симптомов тяжелой ишемии может быть достигнуто путем восстановления глубокой артерии бедра в сочетании с терапевтическим лечением без реконструкции магистральных артерий конечности.
Более часто профундопластику применяют как сопутствующее вмешательство при восстановительных операциях на сосудах аорто-под-вздошного и бедренно-подколенного сегментов.
Профундопластика как самостоятельное вмешательство уменьшает тяжесть ишемии, не устраняя полностью перемежающуюся хромоту, переводит III и IV стадии ишемии во II и даже в I. Улучшение кровообращение бывает' достаточным для заживления язв и некрозов, а также раны культи после экономной ампутации.
Непосредственные и отдаленные результаты реконструкции глубокой артерии бедра при тяжелой ишемии конечности свидетельствуют об улучшении кровотока у 65—80% больных. Эффективность реваскуляризации про-фунды при обширном окклюзионном поражении сосудов аорто-подзвдош-ного и бедренно-подколенно-берцово-го сегментов зависит от просвета глубокой артерии бедра и степени развития ее коллатеральной системы. Наилучшие результаты наблюдаются у больных с анатомически хорошо развитой глубокой артерией бедра и ее коллатеральной системы к сохранившим просвет, хотя и стенозирован-ным, берцовым артериям — улучше-
ние кровотока отмечается у 96,2% больных (Tschirkov с соавт., 1977). В таком случае реваскуляризацию глубокой артерии бедра можно рассматривать как альтернативу реконструкции бедренно-подколенного сегмента. Эффективность операции значительно ниже при малом диаметре глубокой артерии бедра и поражении ее на значительном протяжении, слабо развитых коллатералях к подколенной и берцовым артериям, а также обширных поражениях берцовых артерий.
Профундопластика, несомненно, показана больным с повторной окклюзией после шунтирования веной или дезоблитерации бедренно-подколенного сегмента при одновременном сужении просвета глубокой артерии бедра, а также при стенозе и закупорке ее у больных с тяжелой ишемией конечности и высоким риском операции. По данным литературы, хорошие результаты реваскуляризации глубокой артерии бедра в течение 1 года наблюдаются у 95—70% больных, через 5 лет — у 3/4 оставшихся к этому моменту в живых, а через 10 ле! — почти у Vj живых (Weber с соавт., 1977).
Известен и другой вариант использования глубокой бедренной артерии при окклюзии бедренно-подколенного сегмента — шунтирование веной от глубокой артерии бедра на расстоянии 4—12 см от места ее отхождения до нижнего отдела поверхностной бедренной артерии или к подколенной артерии (К. Ю. Литманович, В. Д. Кар-гин, 1977). Авторы отмечают следующие преимущества этого варианта операции: используется венозный трансплантат меньшей длины, уменьшается опасность повреждения лимфатических путей и лимфатических узлов паховой области, предупреждается или замедляется развитие ате-росклеротических изменений на месте соустья, поскольку анастомоз выполняют с артерией мышечного типа. С нашей точки зрения, этот вариант операции может найти применение. особенно при повторных реконструкциях бедренно-подколенного сегмента.
Техника операций реваскуляриза-ции артерий голени и стопы. Положение больного — на спине, валик в подколенной области.
Вначале выполняют поясничную симпатэктомию на стороне поражения в этом же положении больного.
Следующий этап — обнажение и ревизия артерий голени дистальнее участка окклюзии, а также подкожной вены, которую предполагают использовать для шунтирования.
Доступы к артериям голени. Ди-стальную часть подколенной артерии и ее ветви обнажают обычно через медиальный доступ в верхней трети голени (см. рис. 109). При необходимости выделения тибио-фибулярного ствола, проксимальной части задней большеберцовой и малоберцовой артерий разрез продолжают вниз и частично пересекают медиальную часть m. soleus у места прикрепления ее к большеберцовой кости и сухожильную дугу мышцы. Некоторые авторы (Evans и Bernhard, 1970, и др.) используют латеральный доступ с резекцией верхней трети малоберцовой кости для широкого обнажения области деления подколенной артерии и начальных отделов берцовых сосудов.
Переднюю большеберцовую артерию с целью шунтирования обнажают обычно в верхней и средней третях голени. Конечность ротируют несколько кнутри. Разрез кожи, клетчатки и собственной фасции производят по передне-латеральной поверхности параллельно гребню большеберцовой кости латеральнее его на 3— 4 см. При этом руководствуются проекционной линией: от середины расстояния между головкой малоберцовой кости до бугристости большеберцовой кости к середине расстояния между лодыжками. Дальше разделяют мышцы по межмышечному промежутку между m. tibialis anterior — медиально и группой длинных
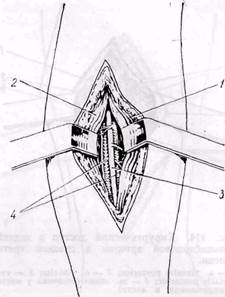
Рис. 113. Доступ к передней большеберцовой артерии:
/ — m. tibialis anterior; 2 — mm. extensor hal-
lucis longus et digitorum longus; 3 —• a. tibialis
anterior. 4 — vv- tibialis anterior
разгибателей (m. extensor digitorum longus и m. extensor hallucis longus) — латерально. Артерия расположена на межкостной мембране. Ее сопровождают вены, обычно 2, и п. peroneus profundus (рис. ИЗ). В нижней трети голени артерия также располагается между сухожилиями m. tibialis anterior и т. extensor hallucis longus. Выделение артерии облегчается при расслаблении мышц путем тыльного сгибания стопы.
Тыльную артерию стопы очень редко используют для шунтирования при распространенных окклюзиях артерий голени. Рассекают кожу, клетчатку и фасцию по проекционной линии — от середины расстояния между обеими лодыжками до первого межпальцевого промежутка. Собственную фасцию стопы рассекают на 1 см кнаружи от сухожилия m. extensor hallucis longus с тем, чтобы избежать повреждения сухожильного влагалища. Края раны разводят и отыскивают тыльную артерию стопы между 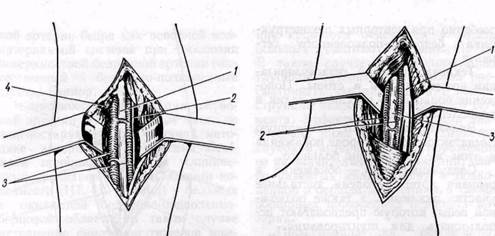
сухожилиями m. extensor hallucis lon-gus и m. extensor hallucis brevis.
Заднюю большеберцовую артерию обнажают через медиальный доступ в верхней, средней или нижней третях голени. При этом конечность ротируют кнаружи.
В средней трети голени (рис. 114) разрез кожи, клетчатки и собственной фасции проводят параллельно задней поверхности большеберцовой кости. Рассекать ткани следует осторожно, чтобы не повредить большую подкожную вену. Ее смещают в сторону. Отводят крючком кзади медиальную головку m. gastrocnemius. M. soleus, расположенную в глубине раны, рассекают в месте прикрепления ее к большеберцовой кости и отводят крючком кзади, после чего в глубине раны обнаруживают сосудисто-нервный пучок. Артерию сопровождают обычно две вены и расположенный книзу от нее п. tibialis.
В нижней трети голени (рис. 115) заднюю большеберцовую артерию обнажают через разрез длиной 6— 8 см по медиальной поверхности голени кпереди от ахиллова сухожилия. Рассекают апоневроз голени, а при необходимости также lig. la-
Рис. 115.Хирургический доступ к задней большеберцовой артерии позади медиальной лодыжки:
/ — п. tibialis; 2 — v. tibialis posterior; 3 — a. tibialis posterior
ciniatum и обнаруживают сосудисто-нервный пучок. Он расположен между m. flexor digitorum longus и т. flexor hallucis longus. Позади медиальной лодыжки сосудисто-нервный пучок расположен между сухожилиями указанных мышц, которые проходят в фиброзных влагалищах.
Малоберцовую артерию в ее проксимальной части обнажают через медиальный разрез в верхней трети голени с частичным рассечением m. soleus. При шунтировании к средней части артерии доступ осуществляют через разрез длиной 8—10 см по латеральной поверхности голени в промежутке между m. peroneus longus et brevis и т. soleus. Последнюю смещают крючком кзади и обнаруживают m. flexor hallucis longus, которую острым путем отделяют от малоберцовых мышц. В глубине раны обнаруживают а. регопеа (рис. 116). В нижней трети голени от малоберцовой артерии обычно отходят га mi communicans к ветвям большебер-цовых артерий. Эти ветви следует оберегать от повреждения.
Для наложения дистального анастомоза используют участок артерии дистальнее окклюзии в месте наиболь-
Рис. 114.Хирургический доступ к задней большеберцовой артерии в средней трети голени:
/ — a. tibialis posterior; 2 — п. tibialis; 3 — vv. tibialis posterior; 4 — m. :oleus (отсечена у места прикрепления к кости) шего просвета сосуда при условии отсутствия сужения его в дистальном направлении. При возможности выбора предпочтение отдают задней большеберцовой артерии.
Некоторые авторы (Garrett с со-авт., 1968, и др.) считают возможным наличие ретроградного кровотока из берцовых артерий вверх до подколенной артерии и утверждают, что шунтирование веной к дистальной части большеберцовых артерий (над лодыжками) имеет преимущество по сравнению с шунтированием к проксимальной части берцовых артерий или к трифуркации подколенной артерии. При этом требуется меньшей длины разрез, сосуды располагаются более поверхностно и более доступны для манипуляций, чем при доступе к трифуркации подколенной и проксимальной части берцовых артерий.
Нередко только после обнажения и ревизии артерий и подкожной вены окончательно решают вопрос о возможности реконструктивной операции.
При достаточной длине большой подкожной вены и величине ее просвета не менее 3—4 мм проксимальный анастомоз обычно накладывают с общей бедренной артерией. По возможности избегают наложения проксимального анастомоза с поверхностной бедренной артерией, так как атеросклеротический процесс быстрее прогрессирует в ней.
Большинство хирургов применяют реверсионный способ шунтирования веной.
Ряд хирургов, располагающих многолетним опытом применения способа in situ, считают, что при длинном шунтировании к подколенной и к берцовым артериям он имеет существенные преимущества по сравнению с реверсионным методом (А. А. Шалимов с соавт., 1975; Hall, 1962, 1964; Skagseth и Hall, 1973; Bohmig с соавт., 1977, и др.).
Способ in situ применяют при реконструкции бедренно-подколенного сегмента не только в случае длинного шунтирования к дистальной части
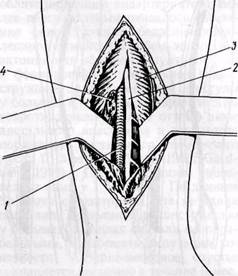
Рис. 116.Хирургический доступ к малоберцовой артерии:
/ — а. регопеа; 2 — п. peroneaus superficialis; 3 — mm. peroneaus longus et breves; 4 — m flexor halluci? longus
подколенной и к берцовым артериям, но также при шунтировании к проксимальной части подколенной артерии (А. А. Шалимов, 1961; В. С. Крылов с соавт., 1968; Skagseth и Hall, 1973, и др.).
Ряд неудач при реверсионном способе шунтирования артерий венозным трансплантатом зависят именно от его реверсии (В. С. Крылов с соавт., 1968). Эти недостатки особенно часто проявляются при длинном и сверхдлинном шунтировании к дистальной части подколенной и к берцовым артериям (May с соавт., 1965; Vollmar, 1967). Основной недостаток заключается в том, что чем длиннее шунт, тем больше несоответствие диаметров анастомозируемых сосудов, так как при длинном трансплантате дисталь-ный конец вены может быть очень малого диаметра и просвет проксимального анастомоза получается малым, в то время как дистальный анастомоз значительно большего диаметра (рис. 117). При реверсионном методе артерии и вена-шунт представ- 

Рис. 117.Схема, иллюстрирующая гемодина-мические особенности ори обходном шунтировании веной методом реверсии (1) и способом in situ (2) (объяснение в тексте)
ляют собой серию каскадов разного диаметра, что может вызвать падение давления (May с соавт., 1965). Это нередко приводит к уменьшению кровотока в области дистального анастомоза и его тромбозу. Полное выделение и извлечение вены при реверсион-ном способе сопровождаются нарушением сосудистых и нервных связей. Возможна также значительная механическая травма вены. Это может явиться причиной фиброза венозного шунта. Недостатками метода являются также опасность перегиба и скручивания трансплантата по оси при проведении его в канале, большая продолжительность операции. Этих основных недостатков удается избежать при шунтировании веной in situ. Нет необходимости в выделении вены по всей окружности на всем ее протяжении и пересечении ее боковых ветвей, что обеспечивает сохранение иннервации и васкуляриза-ции (vasa vasorum) венозной стенки и сокращает продолжительность операции. Опасность перегиба и скручи-
вания венозного шунта по оси при этой методике минимальная. При шунтировании методом in situ отмечается большее соответствие диаметров ана-стомозируемых сосудов и диаметр проксимального анастомоза получается относительно большим, чем при ревер-сионном способе.
При анализе гемодинамических характеристик длинных шунтов in situ установлено, что объемный кровоток действительно возрастает через проксимальную часть венозного трансплантата, а это обеспечивает максимальные величины кровотока через наиболее критический, дистальный анастомоз — в противоположность ре-версионному шунту. В целом, как показали и наши наблюдения, операция выполняется быстрее и техника ее проще (Connolly, 1965).
Реконструкцию артерий конечностей при облитерирующих заболеваниях шунтированием аутовеной с оставлением ее в естественном ложе и разрушением клапанов мы впервые применили в 1961 г. Для шунтирования использовали одноименную вену. Разрушение клапанов достигалось путем их иссечения через поперечные венотомии в месте расположения клапанов. Шунтирование методом in situ с использованием большой подкожной вены впервые применили Hall (1962) и Rob (1963).
Разрушение клапанов достигалось путем их иссечения через отдельные венотомии (Hall, 1962) или путем проведения внутри вены в ретроградном направлении катетера или зонда, предназначенного для венэк-томии (Rob, 1963).
Критика метода in situ основывается на двух основных факторах: 1) опасность оставления открытых ар-терио-венозных соустий после арте-риализации вены; 2) травма венозной стенки при открытом иссечении клапанов, опасность повреждения интимы и сохранение целости створок клапанов при закрытом их разрушении с помощью зондов и специальных кла-паноразрушителей. Как показали исследования (May с соавт., 1965), следует различать два вида боковых ветвей большой подкожной вены — поверхностные и прободные. Разница между ними обусловлена ориентацией створок клапанов. Клапаны поверхностных ветвей ориентированы обычно так, что препятствуют поступлению крови из основного ствола большой подкожной вены в ветви. Если эти венозные ветви не перевязать, они обычно самостоятельно тромбируются.
Прободающие (перфорационные) ветви расположены более глубоко, обычно немногочисленные, клапаны их ориентированы таким образом, что кровь проходит из v. saphena mag-па в систему глубоких вен. Эти ветви обязательно надо перевязывать.
Последствия оставления открытой артерио-венозной фистулы артериа-лизованного венозного шунта при методике in situ не могут быть всегда однозначными. May с соавторами (1965) считает, что функционирующая фистула может оказывать влияние на заживление ран, приводит к значительному «обкрадыванию» артериального кровотока по венозному трансплантату в дистальное артериальное русло, вызывая ишемию и угрожая нарушением проходимости шунта. Выявить артерио-венозную фистулу во время операции можно с помощью стерильного стетоскопа, артерио-графии и некоторых других приемов.
Однако, как показали исследования Blaisdell и соавторов (1966), а также наши наблюдения, отрицательные последствия оставления артерио-венозной фистулы преувеличены.
Были предприняты попытки лечить больных с тяжелой ишемией конечности путем формирования на конечности артерио-венозной фистулы (Halstead и Vaughan, 1912; Root и Crus, 1965; Vett, 1966; Al-Naaman, 1972; Shio-nova с соавт., 1976). Методика арте-риализации вен стопы (Shionova с соавт., 1976) с закрытым разрушением клапанов v. saphena magna с помощью разработанного нами клапаноразру-
шителя применена нами у 1 больного облитерирующим эндартериитом. Более перспективным оказалось сочетание реконструкции бедренно-подколенного сегмента способом зндартери-эктомии или обходного шунтирования с формированием дистальнее реконструкции артерио-венозной фистулы у больных с высоким периферическим сопротивлением сосудов оттока ниже дистального анастомоза в результате поражения дистального сосудистого русла (Blaisdell с соавт., 1966; Gardner, 1966). Такая операция произведена нами у 1 больного. По данным Shionova с соавторами, эта методика позволила выполнить реконструкцию у больных, которых считали неоперабельными, и избежать ампутации конечности. Артерио-венозное соустье сохраняется временно в течение 6 мес. За это время обычно развиваются коллатеральные сосуды, что позволяет перевязать фистулу и сохранить конечность, однако необходимы дальнейшие исследования для оценки перспективности этого метода хирургического лечения.
Исследования Blaisdell с соавторами (1966) показали, что фистула диаметром 4—5 мм (равная диаметру большой подкожной вены) не оказывает в течение этого времени выраженного отрицательного эффекта на общую гемодинамику, венозную систему конечности, не уменьшает значительно перфузии дистального артериального русла. При увеличении диаметра фистулы и выявлении признаков отрицательного эффекта показана перевязка ее.
Диаметр просвета боковых ветвей v. saphena magna обычно значительно меньше 5 мм, поэтому, как показал наш опыт, опасность выраженного отрицательного воздействия фистулы на общую гемодинамику и венозную систему конечности при функционировании ее в течение нескольких месяцев после операции в области бедра явно преувеличена. Случайное или преднамеренное оставление боковых ветвей v. saphena magna неперевя- занньши, как показали наши наблюдения, не оказало явно выраженного отрицательного эффекта. Мы отмечали также быстрое заживление огромных трофических язв стопы у этих больных. Возможно, что оставление артерио-венозной фистулы в определенной степени даже способствует заживлению некрозов. По крайней мере, отрицательного эффекта мы не отмечали. Через 3—6 мес мы перевязывали фистулы, что не представляло трудностей, поскольку место их расположения легко определялось при аускультации и пальпации.
Необходимы дальнейшие исследования для объективной оценки влияния артерио-венозного cfpoca крови из артериализованного венозного шунта, однако, на наш взгляд, его нельзя рассматривать как существенный недостаток методики шунтирования веной in situ.
Сложной и недостаточно решенной проблемой является надежное и безопасное, без повреждения стенки вены, разрушение венозных клапанов. На наш взгляд, отсутствие простых и безопасных способов и инструментов для закрытого разрушения клапанов является основной причиной относительно редкого применения метода in situ.
Известны различные способы разрушения клапанов венозного шунта: открытый — путем их иссечения через отдельные поперечные венотомии в месте расположения клапанов (А. А. Шалимов, 1961; Hall, 1962, и др.); закрытый — путем введения в просвет вены пластмассовых катетеров и различных зондов («stripper» — в английской литературе), состоящих из утолщения (оливы), фиксированного на конце гибкого тросика или стержня, обычно используемых для венэктомии (Bellman с соавт., 1966; Samuels с соавт., 1968; Bohmig с соавт., 1977, и др.), а также специальных клапаноразрушителей (Skagseth и Hall, 1973).
Недостатки открытого способа — большая продолжительность опера-
ции, необходимость множественных разрезов стенки вены, что сопряжено с возможностью тромбирования ее в этих местах. При закрытом способе зонд вводят в ретроградном по отношению к клапанам направлении и разрывают их лепестки, или антеград-ном, вызывая при обратном движении растяжение и выворачивание лепестков клапанов. Недостаток указанных закрытых способов заключается в том, что при ретроградном введении зонд часто попадает в боковые ветви вены или не разрывает всех лепестков клапана в связи с прилеганием их к внутренней стенке вены, вследствие чего нередко после операции возникает тромбоз венозного шунта. Для растяжения и выворачивания лепестков клапанов необходимо использовать зонды относительно большого диаметра, в связи с чем при проведении их происходит повреждение внутренней оболочки вены, что также может вызвать тромбоз шунта.
Из известных в литературе методов закрытого разрушения венозных клапанов наиболее эффективным является способ механического разрушения клапанов специальным клапа-норазрушителем (Skagseth и Hall, 1973), содержащим две цилиндрические канюли, фиксированные на гибком тросе. Передняя по движению канюля является направляющей, а задняя — разрушающей, так как конец ее косо срезан и имеет вид крючка для захвата и разрыва лепестков клапана. Направляющая канюля прижимает внутреннюю оболочку вены в области клапана, предохраняя ее от разрыва.
Недостатком указанного устройства, как показали наши наблюдения, является то, что не происходит разрушения всех лепестков клапанов, так как направляющая канюля оттесняет их к венозной стенке, препятствуя тем самым захвату лепестков крючкообразными выступами. Поскольку диаметры обеих канюль одинаковые, направляющая канюля, которая следует впереди разрушающей, в определенной мере предохраняет стенку вены от повреждения крючкообразными выступами разрушающей канюли и стабилизирует положение последней параллельно стенке вены. Однако, поскольку стенка вены обладает выраженной эластичностью и сократимостью, одна только направляющая канюля не гарантирует от повреждения внутренней оболочки стенки вены и от возможности попадания крючкообразных выступов в устье боковых ветвей вены, что влечет за собой разрыв ее стенки.
Мы разработали несколько вариантов устройств для разрушения венозных клапанов закрытым способом. Эффективность их действия вначале была изучена на трупах при разрушении клапанов большой подкожной вены.
В результате этих исследований 3 варианта конструкций клапано-разрушителей были выбраны для применения в клинике.
Вначале, с 1973 г., мы применяли зонд, конструкция и принцип действия которого схематически представлены на рис. 118. Зонд содержит металлическую оливу, фиксированную на гибком тросе на расстоянии 5 и 70 см от его концов. В средней части оливы имеются поперечные прорези шириной 1 мм, глубиной 2 мм, выполненные под углом 45° к продольной ее оси. Прорези (всего 4) располагаются, как указано на чертежах, в двух взаимно перпендикулярных плоскостях. Изготовлено 5 вариантов зондов с оливами диаметром 3, 4, 5, 6 и 7 мм. Зонд вводят обычно с дистального конца вены или же ретроградно через проксимальный ее конец с помощью пластмассового катетера-проводника, в просвет которого вставляют конец зонда. При проведении зонда в ретроградном направлении лепестки клапанов попадают в прорези и разрываются острым краем оливы. Диаметр оливы на уровне острого и тупого краев прорези одинаковый, что предохраняет стенку вены от повреждения и предупрежда-
Рис. 118. Устройство для разрушения венозных клапанов:
а — общий вид; б — схема действия; 1,2 — направляющая часть гибкого троса с утолщением на конце; 3 — стенка вены; 4 — металлическая олива с прорезями; 5 — венозный клапан; 6 —•
гибкий трос
ет попадание острого края в боковые ветви вены при повреждении зонда. В момент проведения зонда в вену вводят в ретроградном направлении физиологический раствор с гепарином. Последнее обстоятельство существенно важно, в отличие от методики, описанной Skagseth и Hall (1973), так как лепестки клапана отгибаются током жидкости вовнутрь в просвет вены, а стенка ее кнаружи, что обеспечивает надежный захват и разрушение лепестков клапанов и предупреждает повреждение внутренней оболочки вены. Контролем достаточности разрушения клапанов является свободное, в виде струи, вытекание раствора через нижнее сечение вены и отсутствие сопротивления при введении жидкости.
Результаты применения клапано-разрушителя у 48 больных с окклю-
_____________________________ 257 
Рис. 119.Устройство для закрытого разрушения клапанов венозного шунта:
А — внешний вид; Б — схема действия; В — схема операции бедренно-подколенного шунтирования веной in situ при тромбозе бедренной артерии; / — выделение вены-шунта и перевязка ее боковых ветвей; 5 — разрушение клапанов вены-шунта с помощью устройства; 3 — наложение верхнего и нижнего анастомозов вены и артерии; 4 — схема операции
зией артерий нижних конечностей при бедренно-подколенном и бедренно-берцовом шунтировании большой подкожной веной показал высокую эффективность действия указанного зонда (А. А. Шалимов с соавт., 1975).
Применив существенно важный прием — создание ретроградного тока жидкости в момент проведения клапаноразрушителя, что принципиально улучшает качество проводимой операции, мы внесли изменения в конструкцию клапаноразрушителя и создали новую модель (рис. 119).
Устройство для разрушения венозных клапанов содержит направляющую и разрушающую с зубчатыми выступами канюли, фиксированные на гибком тросе. Разрушающая канюля имеет наклонные каналы и штуцер с осевым каналом, причем наклонные каналы соединены с осевым, что обеспечивает возможность подведения жидкости, например физиологического раствора с гепарином, между стенкой вены и канюлей в месте крючкообразных выступов. Благодаря этому повышается надежность захвата и разрушаются все лепестки клапана, без повреждения
внутренней стенки вены и попадания зубчатых выступов в боковые ветви.
При проведении устройства внутри вены в месте прохождения разрушающей канюли лепестки клапана отгибаются вовнутрь в просвет вены, а стенка ее кнаружи путем создания дозированного движения жидкости в ретроградном по отношению к клапанам направлении.
Устройство работает следующим образом. На штуцер надевают эластическую трубку и проводят устройство в вену в ретроградном по отношению к клапанам направлении. Через эластическую трубку, штуцер и далее через радиальные каналы до-зированно подводят жидкость, например физиологический раствор, между стенкой вены и зубчатыми выступами. За счет движения жидкости лепестки клапана отгибаются вовнутрь вены и захватываются зубчатыми выступами, а стенка вены в этом месте отгибается кнаружи. При дальнейшем продвижении устройства происходит разрыв лепестков клапана.
Под разрушением створки клапана с помощью указанного устройства подразумевается разрыв (рассечение) свободного края створки и самой створки на части без повреждения прикрепленного ее края. Рассеченные на части створки клапана остаются фиксированными к венозной стенке на прикрепленном крае створки. Током крови они отжимаются к венозной стенке, не препятствуя кровотоку.
Гибкий трос служит для проведения устройства в вене. Первоначальное проведение его через вену в ретроградном направлении осуществляется с помощью предварительно введенного антеградно катетера (конец тросика вставляют в просвет катетера) или специального проводника. Обратное — в антеградном направлении — проведение клапаноразрушите-ля внутри вены при необходимости повторного проведения его для разрушения клапанов осуществляют с помощью катетера, фиксированного к штуцеру устройства.
Контролем радикальности разрушения клапанов является свободное, в виде струи, вытекание раствора через нижнее сечение вены и отсутствие сопротивления при проведении пластмассового катетера или гибкого зонда.
Техника операции обходного шунтирования веной in situ обычно бывает следующей (см. рис. 119). Обнажают артерию и большую подкожную вену в предполагаемых местах проксимального и дистального анастомозов с целью определения пригодности их к реконструкции. При сомнительных данных ангиографии в отношении проходимости дистальных артерий для определения пригодности их к реконструкции производят продольную артериотомию, определяют характер ретроградного кровотока и проходимость дистальных отделов артерии с помощью сосудистого зонда или катетера. При необходимости производят дистальную артериографию. Хирургические манипуляции на берцовых артериях должны быть максимально атравматичными.
Большую подкожную вену пересекают у места впадения ее в бедренную вену и на уровне предполагаемо-
го"дистального анастомоза. Затем выделяют переднюю стенку вены на всем ее протяжении через несколько отдельных кожных разрезов длиной 2—3 см с тем, чтобы выявить и перевязать ее боковые ветви. Последние не пересекают, а перевязывают таким образом, чтобы не захватить в лигатуру адвентицию стенки основного ствола большой подкожной вены и не вызвать сужения ее перетяжками адвентиции. Затем через введенный в дистальный конец вены катетер нагнетают физиологический раствор с гепарином и производят гидравлическое расширение вены-шунта. Пережимая ее, убеждаются в герметичности вену и лигировании всех боковых ее ветвей.
Наложение металлических сосудистых зажимов на берцовые артерии может быть причиной значительной травмы сосудистой стенки и последующего тромбоза. Лучше пережимать указанные сосуды лигатурными петлями или специальными микрососудистыми клипсами.
Через верхний разрез вены иссекают проксимально расположенный клапан. Катетер проводят через весь шунт в проксимальном направлении и затем с его помощью проводят в дистальном направлении тросик кла-паноразрушителя. Клапаноразруши-тель проводят внутри вены-шунта с помощью тросика с утолщением на конце в ретроградном по отношению к клапанам направлении. При проведении клапаноразрушителя дозиро-ванно подводят физиологический раствор с гепарином через эластическую трубку и осуществляют визуальный контроль через кожные разрезы. В момент разрыва лепестков клапанов ощущается легкое сопротивление. Повторно проводят клапаноразруши-тель — 2—3 раза. Затем клапанораз-рушитель удаляют и вену промывают раствором гепарина. Раствор должен свободно, в виде струи, вытекать через дистальный конец вены. Пережимая вену, убеждаются в ее герметичности. 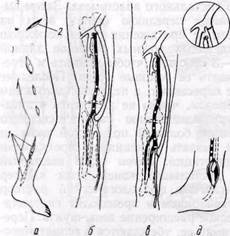
Рис. 120.Схема этапов операции бедренно-заднеберцового аутовенозного шунтирования:
а — схемы разрезов для доступа к различным отделам заднеберцовой артерии (1), подкожной вене и поясничному отделу симпатического ствола с целью симпатзктомни (2); б — д — уровни наложения дистального анастомоза и проксимального анастомоза (2)
Перед наложением анастомозов с берцовыми артериями целесообразно расширить их просвет с помощью специальных металлических или пластмассовых бужей-дилататоров диаметром от 2 до 4 мм, чтобы снять артериальный спазм (Г. А. Нацвли-швили и Н. К. Бохуа, 1974; Г. В. Говорунов с соавт., 1975; Garret ссоавт., 1968, и др.). Проксимальный анастомоз выполняем, как правило, в первую очередь по типу конец в бок общей бедренной артерии или конец в конец проксимальной части поверхностной бедренной артерии; кратковременно снимая зажим с артерии, проверяют напряжение и пульсацию шунта в дистальном его отделе, чтобы исключить сохранение целости лепестков клапанов. Применяем ручной обвивной сосудистый шов атравмати-ческими иглами синтетической нитью 4—0 и 5—0.
С целью создания максимально широкого проксимального анастомоза некоторые хирурги (Skagseth и Hall, 1973) отсекают устье большой подкожной вены вместе с небольшим уча-
стком (венчиком) бедренной артерии. Проксимальный анастомоз также может быть расширен в некоторых случаях с использованием боковой ветви вены (Bartos, 1972).
Дистальный анастомоз с берцовыми сосудами выполняем по типу конец вены в бок артерии, используя атрав-матические иглы с нитью 5—0 и 6—0. Для успеха операции важно, чтобы шунт имел диаметр не менее 4 мм. Кроме того, шунт не должен быть слишком коротким, чтобы не было натяжения в области анастомозов, или длинным из-за опасности перегибов. Снимают зажимы сначала с ди-стальных, а затем и с проксимальных сосудов. Проверяют пульсацию и напряжение шунта и сосудов дистальнее анастомозов. Измеряют объемную скорость кровотока в венозном шунте с помощью электромагнитного флоу-метра, что позволяет в определенной степени оценить эффективность шунта и исключить в некоторых случаях возможные технические ошибки.
Раны послойно зашивают с оставлением резиновых выпускников. Некоторые авторы рекомендуют выполнять на операционном столе артерио-графию с целью выявления открытых артерио-венозных соустий и неразрушенных лепестков клапанов (Barnes с соавт., 1969; Skagseth и Hall, 1973). Техника операций шунтирования к отдельным берцовым артериям представлена на рис. 120—122.
При шунтировании веной методом реверсии обычно применяют технику операции, разработанную Kunlin в 1948 г. Большую подкожную вену выделяют из небольших разрезов на внутренней поверхности бедра и голени той же конечности (Garrett с соавт., 1968; Noon с соавт., 1969, и др.) или из одного разреза на бедре (Reichart с соавт., 1974, и др.). Тщательно перевязывают боковые ветви. Важным этапом является проведение трансплантата через подкожный туннель. С целью предупреждения скручивания шунта по оси при проведении его в туннеле рекомендуют маркиро- 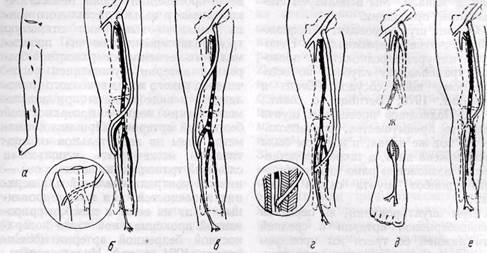
Рис.121. Лапы операции бедренно-переднебольшеберцового аутовенозного шунтирования:
а — схема разрезов; 6 — е — уровни наложения анастомоза с передней берцовой артерией и пути приведения шунта по ходу артерии (б), по латеральной поверхности области коленного сустава иго-лени (в), через внутрикостный канал в большеберцовой кости (г); ж — уровни анастомозирования шунта с бедренной артерией
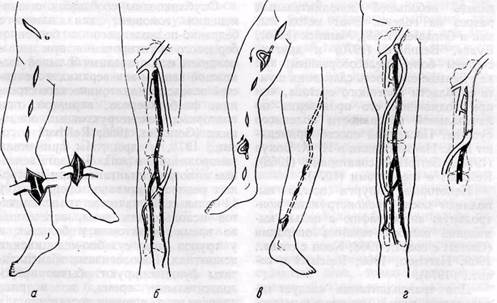
Рис. 122.Этапы операции бедренно-малоберцового аутовенозного шунтирования:
а, в — схемы разрезов для доступа к артериям и подкожной вене; б, ? — уровни наложения анастомозов с малоберцовой артерией и бедренной артерией (г)
вать вену по всей ее длине метилено ную вдоль пластмассовую трубку,
вым синим (Schwartz, 1973) или ис- в которую закладывают венозный
пользовать специальные проводники, трансплантат. Трубку проводят по
Г. В. Говорунов с соавторами (1975) проложенному каналу до паховой об-
использует для этих целей рассечен- ласти и здесь извлекают, оставляя вену в канале. Мы используем специальный проводник.
Обычно шунт проводят в подкожной клетчатке эпифасциально. Некоторые хирурги предпочитают проводить трансплантат глубоко по естественному ходу сосудов (Evans и Bernhard, 1970; Bernhard с соавт., 1972). Подкожное проведение шунта имеет то преимущество, что используется тот же канал, в котором была расположена вена, а также представляется возможным рано диагностировать тромбоз шунта самим больным.
При шунтировании к передней большеберцовой артерии в средней или нижней ее трети мы проводим дистальную часть трансплантата (также по методике in situ) по естественному ходу артерии, то есть через отверстие в верхней части межкостной мембраны. С этой целью приходится делать небольшой дополнительный разрез на голени. Этот метод мы, как и Gonzales (1968), Mannick (1968), Evans, Bernhard (1970) и другие, считаем более целесообразным, так как меньше опасность сдавления шунта в области коленного сустава, чем при подкожном его проведении по латеральной поверхности коленного сустава. Последний способ применяют Г. А. Нацвлишвили и Н. К. Бохуа (1974), Garrett с соавторами (1968), Reichart с соавторами (1974).
Некоторые хирурги всегда выполняют после реконструкции контрольную ангиографию с целью выявления ошибок техники операции (Garrett с соавт., 1968; Noon с соавт., 1969; Harrison, 1969; Reichart с соавт., 1974).
Для трансплантации следует использовать вену с минимальным диаметром не менее 3,5—4 мм. Как показали клинические наблюдения, венозные шунты меньшего диаметра у большинства больных тромбируются в течение первого года (Hall, 1964, и др.). Необходимая длина венозных трансплантатов — 40—70 мм. Вена не всегда имеет достаточный диаметр на
всем протяжении. Если недостаточный диаметр только дистального конца вены, то выполняют открытую тромбэндартериэктомию из проксимального сегмента поверхностной бедренной артерии с ушиванием рассеченного узкого конца венозного транс-лантата в виде заплаты при анасто-мозировании вены с поверхностной бедренной артерией. При малом диаметре вены на значительном ее протяжении может быть использован сложный трансплантат из двух вен — нижней контралатеральной или верхних конечностей, или комбинированный шунт из вены и дезоблитериро-ванной проксимальной части поверхностной бедренной артерии (Nielu-bowicz, 1974, и др.). Иногда используют комбинированные шунты из аллопротеза и вены, которую располагают в области коленного сустава и голени.
Опубликованы сообщения о применении гомовены для длинного бедренно-подколенного и бедренно-берцового шунтирования при невозможности использования большой подкожной вены и вен верхних конечностей вследствие анатомического строения, флебосклероза, варикоза, при повторных реконструктивных операциях (Gonzales, 1968; Reichart с соавт., 1974, и др.). Мы применили замороженные в жидком азоте венозные аллотрансплантанты при повторных реконструктивных операциях у 14 больных. В качестве трансплантатов использовали вены, иссеченные во время венэктомии у больных и у трупов при судебно-медицинских вскрытиях. Гомологичные трансплантаты функционируют обычно непродолжительное время, но в ряде случаев этого времени достаточно для заживления язв, некрозов и развития коллатерального кровообращения, что позволяет спасти конечность от ампутации. Гомовена может быть применена только у больных с ишемией тяжелой "степени, которым угрожает высокая ампутация конечности- Техника операций реваскуляри-зации артерий голени при облитери-рующих заболеваниях сложная, трудоемкая. Причины технических трудностей обусловлены малым диаметром берцовых артерий (2—3 мм и даже меньше), особенно при облитерирую-щем эндартериите, нередким поражением и малым диаметром большой подкожной вены, используемой для шунтирования.
Улучшить результаты лечения больных позволило применение в последние годы микрохирургической техники, увеличивающих устройств и очень тонких нитей (6—0, 8—0, 10—0) для наложения анастомозов.
Операции на сосудах малого диаметра под увеличением — новый и молодой раздел ангиохирургии. Микрохирургия сосудов быстро развивается и в ближайшем будущем, несомненно, будет широко применяться в клиниках хирургии сосудов, при трансплантации органов и тканей, в пластической и экспериментальной хирургии. Благодаря микрохирургической технике, использованию операционных микроскопов, специального оборудования и инструментария становятся возможными реплантация отторгнутой конечности, пальцев и кисти (Б. В. Петровский и В. С. Крылов, 1976; Б. В. Петровский с соавт., 1977; Biemer, Duspiva, 1976; O'Brien, 1976, и др.), микрохирургические операции на артериях голени и стопы (В. С. Крылов с соавт., 1977), коронарных артериях, периферических нервах и лимфатических сосудах (Б. В. Петровский, В. С. Крылов, 1976) и на других структурах, которые ранее не были доступны хирургу. Дальнейшее развитие микрохирургии требует усовершенствования и создания новых инструментов и увеличивающих приспособлений.
В Киевском НИИ клинической и экспериментальной хирургии разработка различных вопросов микрохирургии сосудов ведется с 1973 г. Основные аспекты этих исследований
сводятся к следующему: 1) разработка специального инструментария и оптических приспособлений, предназначенных для выполнения операций на сосудах малого диаметра;
2) разработка методов восстановительных операций на коронарных сосудах сердца, в частности аорто-коронар-ного шунтирования и эндартериэкто-мии из коронарных артерий с применением увеличивающих луп-очков;
3) разработка и усовершенствование методов операций на кровеносных сосудах голени и предплечья при окклю-зионных или травматических поражениях; 4) применение микрохирургической техники при реплантации верхней конечности, пальцев, кисти.
Пока лишь отдельные микрохирургические клиники в нашей стране оснащены современными операционными микроскопами и другим специальным оборудованием. Однако операционный микроскоп не всегда может быть применен, например для выполнения шва на сосудах при значительной глубине раны. Кроме того, при операциях на сосудах диаметром 1,5—3 мм нет необходимости применять большое увеличение, которое обеспечивает операционный микроскоп. Достаточным является, и это значительно упрощает и облегчает проведение операции, обеспечивает хирургу определенную мобильность,— использование специальных операционных луп-очков. Широкое применение их, по нашему мнению, уже сейчас позволило бы значительно повысить эффективность операций, так как с их помощью можно анатомично, технически совершенно выполнить сосудистый шов, точно адаптировать края и оболочки сосудов малого диаметра, что является важным средством предупреждения послеоперационных тромбозов.
Нами совместно с А. В. Спивак и И. Л. Каменчук предложены бинокулярные стереоскопические устройства для хирурга (рис. 123; А. А. Шалимов, 1977), дающие увеличение в 4—6 раз. 
Рис. 123. Бинокулярные стереоскопические устр ойства
Конструкции этих стереоскопических устройств имеют качественно улучшенные технические и эксплуатационные характеристики, которые максимально удовлетворяют требованиям к увеличивающим приспособлениям, используемым в хирургии.
Отличительной особенностью конструкции предложенных устройств является наличие светоделительных пластин, установленных между окуляром и зрачком выхода системы под углом к оптической оси окуляров. Подобное отличие позволяет осуществлять одновременное наблюдение одного и того же объекта с увеличением и без увеличения при неизменной установке зрительной оси глаз, то есть видение и восприятие объемного изображения отдельных структур под увеличением через оптическую систему и одновременно всего оперируемого органа непосредственно глазами. Это уменьшает утомляемость и создает удобства в работе хирурга.
Вторая важная особенность — достигнуто повышение увеличения оптической системы при одновременном сохранении малых габаритов в направлении наблюдения, что улучшает
условия работы хирурга. Это достигается тем, что оптические оси объектива и окуляра каждого монокуляра расположены в плоскости, параллельной плоскости объекта, а оборачивающая призменная система выполнена из неподвижной прямоугольной призмы, установленной перед объективом, и прямоугольной, подвижно установленной между объективом и окуляром перпендикулярно своей гипотенузной гранью оптическим осям объектива и окуляра.
Применение опытных образцов предложенных стереоскопических увеличивающих устройств в клинике при операциях на сосудах малого диаметра полностью подтвердило описываемый положительный эффект.
Стереоскопические лупы-очки применены при операциях аорто-коро-нарного шунтирования у 28 больных ишемической болезнью сердца. Применение оптических увеличивающих устройств при шунтировании артерий очень малого диаметра (1—1,5 мм) позволило улучшить технику наложения анастомоза. Кроме того, облегчается отыскание и выделение коронарных артерий, выбор оптимального участка артерии для наложения анастомоза, удается более точно рассечь коронарную артерию, щадя колла-терали и не повреждая интиму противоположной стенки сосуда.
Стереоскопические лупы-очки применены у 49 больных с облитерирую-щими заболеваниями сосудов конечностей при операциях шунтирования артерий голени.
Увеличительное устройство использовали при выполнении дисталь-ного анастомоза венозного шунта с одной из берцовых артерий у 17 больных (задней болынеберцовой —• у 8, с передней берцовой — у 8, с малоберцовой — У 1) или с дистальным участком подколенной артерии в области ее трифуркации у 32 больных. У большинства больных последней группы, у которых анастомоз наложен с подколенной артерией, сохранялась проходимость лишь одной из 
Рис. 124.Операционный микроскоп: две стсреонасадки, смонтированные на одном
штативе
артерий голени — передней или задней большеберцовой. При этом обходное шунтирование сочетали с энд-артериэктомией из дистального отдела стенозированной подколенной артерии. Диаметр этого участка подколенной артерии обычно 3—4 мм. Применение луп-очков в этих случаях обеспечило выполнение сосудистого шва, технически более совершенного анастомоза, с использованием нити 5—0, 6—0 при минимальной травма-тизации стенки артерии и вены. Четкая видимость под увеличением всех деталей строения сосуда и анастомоза позволяет избежать технических погрешностей, улучшает условия работы хирурга, не требует специальной тренировки для координации движений соответственно изменению зрительного восприятия (как, например, при использовании операционного микроскопа), обеспечивает возможность выполнения манипуляций также при достаточно большой глубине раны (например, при медиальном доступе к подколенной артерии), когда использование операционного микроскопа практически было бы невозможным. Важным достоинством указанных стереоскопических устройств является их доступность при условии серийного производства, что делает их пригодными для широкого внедрения в клиническую практику при различных видах операций на мелких объектах.
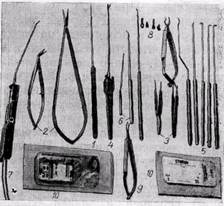
рис. 125.Инструменты для микрохирургии:
/ — скальпель-копье; 2 — ножницы с пружинными ручками; 3 — пинцеты для завязывания нитей; 4 — ножницы; 5 — крючки для микрохирургии; :• — микробужи; 7 — прибор для увлажнения операционного поля и отсасывания жидкости; 8 — клипсы и инструмент для их наложения и снятия; 9 — иглодержатель; 10 — атрав-матические иглы с нитью 6—0 и 10—0 фир-^ мы «Ethicon» в упаковке
Результаты операций шунтирования артерий голени: из 16 больных, у которых анастомоз венозного шу-нта выполнен с берцовыми артериями, успешная реваскуляризация достигнута у 14, у 2 — возник тромбоз, в связи с чем у 1 больного ампутирована конечность; из 32 больных, у которых анастомоз наложен между веной и дистальной частью подколенной артерии, успешная реваскуляризация конечности наблюдалась у 29, тромбоз возник в послеоперационный период у 3, в связи с чем у 2 больных ампутирована голень.
Таким образом, хорошие ближайшие результаты получены у 89,6% больных. Эти данные свидетельствуют о высокой эффективности операций, учитывая распространенный характер окклюзионного поражения артерий бедра и голени и тяжелую степень ишемии.
У больных с очень малым диаметром берцовых артерий (1,5—2 мм) при наложений анастомоза мы применяем операционный микроскоп и специальные микрохирургические инструменты (рис. 124, 125). Используем операционный микроскоп фирмы
«Carl Zeiss». При этом мы смонтировали два бинокулярных тубуса для хирурга и ассистента на одном штативе. Кратность увеличения 5, 8, 12,5, 20, 32, однако обычно использовали увеличение в 5, 8, 12,5 раза. Во время операции мы применяем специальные кресла с подлокотниками, которые позволяют сохранять неподвижность предплечий и совершать точные движения кистью. Применение микрохирургической техники и операционного микроскопа позволило успешно осуществить реваскуляри-эацию передней и задней больше-берцовых артерий диаметром 1 и 1,5 мм у 2 больных облитерирующим эндартериитом 16 и 35 лет с IV стадией ишемии конечности. Восстановлена пульсация на соответствующих артериях стопы и устранены симптомы ишемии.
Таким образом, применение увеличительных приспособлений и микрохирургической техники позволяет выполнить технически правильно шов мелких сосудов, избежать технических погрешностей при наложении анастомозов сосудов малого диаметра, открывает новые возможности хирургического лечения больных облитери-рующими заболеваниями конечностей, позволяет улучшить результаты лечения больных.
Дата добавления: 2015-07-18; просмотров: 2465;
