Основна. 1. Вода як складова сировини і харчових продуктів
1. с.278 – 344
2. с.305 – 336
3. с.53 - 56
4. с. 141 - 157
Тема 8
Вода
План
1. Вода як складова сировини і харчових продуктів
2. Значення води для життєдіяльності людини
3. Фізичні і хімічні властивості води
4. Методи визначення вологи
1. Вода як складова сировини і харчових продуктів
Вода – важлива складова рослинних і тваринних продуктів, як клітинний так і позаклітинний компонент, як диспергуюче середовище і розчинник, обумовлюючи при цьому їх консистенцію, структуру, смак, зовнішній вигляд, стійкість продуктів при зберіганні.
Завдяки фізичній взаємодії з білками, полісахаридами, ліпідами і солями вода суттєво впливає на текстуру продуктів.
Вміст вологи в харчових продуктах (в%) змінюється в широких межах:
М'ясо – 65-75; молоко – 87; фрукти і овочі – 70-95; хліб 35-40; мед – 20; масло, маргарин – 16-18; борошно – 12-14; кофе зерна (обсмажені) – 5; сухе молоко – 4; пиво, соки – 87-90; сир – 37; джем – 28.
Вміст вологи у продуктах негативно позначається на їх стабільності в процесі зберігання.
Вода безпосередньо бере участь у гідролітичних процесах, її видалення чи зв’язування за рахунок підвищення вмісту солі чи цукру гальмує реакції і інгібує ріст мікроорганізмів, таким чином подовжуючи терміни зберігання продуктів.
2. Значення води для життєдіяльності людини
Якщо без їжі людина може прожити 20 і більше днів, то без води – тільки 5-7 днів.
Тіло людини на 50-70% складається з води. Кількість води в організмі людини залежить від віку і складу тіла, особливо від співвідношення м’язової та жирової тканин. М’язова тканина містить більше води, ніж жирова. Оскільки організм чоловіка в середньому містить більше м’язової та жирової тканини, ніж жіночий, то і води в тілі чоловіків міститься більше, ніж у тілі жінки того ж віку.
В молодому віці переважає м’язова тканина, що і обумовлює більший вміст води в організмі молодих людей, ніж похилих.
Вода потрібна людині як середовище – розчинник для виконання різних функцій:
- перетравлювання, всмоктування і транспортування харчових речовин через стінку кишковика;
- розчинення продуктів обміну і виведення їх з сечею;
- забезпечення середовищем, в якому протікають усі біохімічні реакції;
- передачі електричних сигналів (імпульсів) між клітинами;
- регулювання температури тіла (при випаровуванні води тіло охолоджується);
- формування середовища змащування для рухомих частин тіла, наприклад у суглобах;
- забезпеченя організма фтором, кальцієм і іншими МЕ.
Запаси води в організмі обмежені, тому людині слід постійно поповнювати її витрати.
Величина цих витрат коливається у досить значних межах і складає:
- з повітрям, що видихаємо і потом – 800-1200 мл;
- з сечею – 600-1600 мл;
- з калом – 50-200 мл.
При складанні цих витрат виходить, що людині на день потрібно від 1,5 до 3 л води (в середньому 2 л). Витрати води зростають при підвищенні температури навколишнього середовища, фізичного навантаження.
При надмірному вживанні води підвищується навантаження на серце та нирки, із організму виводиться більше мінеральних речовин і вітамінів.
При обмеженому вживанніводи підвищується концентрація сечі, в ній можуть випадати в осад солі, зменшується виділення із крові шлаків (продуктів обміну речовин).
3. Фізичні і хімічні властивості води
Вода має молекулярну масу рівну 18.02 і може існувати у стані рідини, пари та льоду.
Температура замерзання (плавлення) води - 0°С, кипіння - 100°С. При замерзанні вода розширюється, внаслідок чого щільність льоду нижча, ніж води (лід плаває у воді).
Теплопровідність води вища, ніж інших рідин, а льоду більша, ніж інших неметалевих твердих речовин. При цьому теплопровідність льоду при 0°С майже у чотири рази більша, ніж води. Тобто лід поводить тепло значно швидше, ніж нерухома вода, що знаходиться у тканинах. Якщо при цьому врахувати те, що температуропровідність льоду на порядок вища за воду, стає зрозумілим, чому тканини замерзають швидше, ніж розмерзаються.
У зв’язку з цим доречно розглянути діаграму стану води.
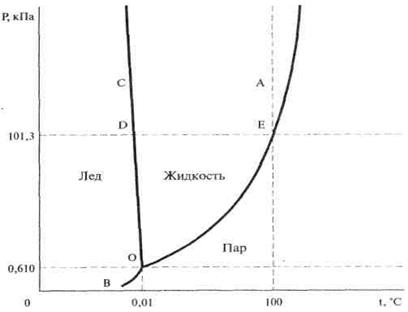
Діаграма стану води (або фазова діаграма) являє собою графічне зображення залежності між величинами, що характеризують стан системи і фазові перетворення у системі (перехід з твердого стану в рідкий, із рідкого у газоподібний і т.д.).
Для однокомпонентних систем використовують діаграму стану, що показує залежність фазових перетворень від температури і тиску; Вони називаються діаграмами в координатах Р-t. Кожній точці на діаграмі відповідає конкретна температура і тиск.
Діаграма показує ті стани води, які термодинамічно стійкі при конкретних значеннях температури і тиску.
Вона складається із трьох кривих, які поділяють усі можливі температури і тиски на три області, що відповідають льоду, рідині і парі.
|
Діаграма стану води в області невисокого тиску
Крива ОА – характеризує залежність насиченої водяної пари від температури: точки кривої показують ті пари значень Т і Р, при яких рідка вода і водяна пара знаходяться у рівновазі.
Крива ОА називається кривою рівноваги рідина – пара або кривою кипіння.
Крива ОС – крива рівноваги твердий стан – рідина, або крива плавлення, показує ті пари значень при яких лід і рідка вода знаходяться у рівновазі.
Крива ОВ – крива рівноваги твердий стан – пара, або крива сублімації (фазовий перехід першого роду із твердого стану безпосередньо без плавлення в газоподібне).
Усі три криві перетинаються у точці О.
Координати цієї точки – це єдина пара значень Т і Р, при яких у рівновазі можуть знаходитись усі три фази: лід, рідка вода і пара. Ця точка називається – трійною точкою.
Цій точці відповідає тиск водяної пари 0,610 кПа (4,58 мм рт.ст) і температура 0,01°С.
Ця діаграма має значення при розробці технологічних режимів одержання харчових продуктів.
Наприклад, якщо лід нагрівається при тиску (Р) нижче ніж 0,610 кПа, то він безпосередньо переходить у пару. Це є основою при розробці способів одержання харчових продуктів сушкою і заморожуванням.
Однією із особливостей води, є зменшення температури плавлення льоду зі збільшенням тиску (Р).
Крива ОС на діаграмі стану води йде вверх вліво, тоді як для усіх інших речовин вона іде вверх вправо.
Перетворення, що відбувається з водою при атмосферному тиску, показані на діаграмі точками чи відрізками, розташованими на горизонталі, що відповідає 101,3 кПа (760 мм рт.ст).
Так, плавленню льоду чи кристалізації води відповідає точка D, кипінню води – точка Е, нагріванню чи охолодженню води – відрізки D і Е.
Загальна вологість продукту указує на кількість вологи у ньому, але не характеризує її причетність до хімічних, біохімічних мікробіологічних змін в продукті. У забезпеченні його стійкості при зберіганні важливу роль відіграє співвідношення вільної і зв’язаної вологи.
Зв’язана волога – це асоційована вода, міцно зв’язана з різними компонентами – білками, ліпідами і вуглеводами за рахунок хімічних і фізичних зв’язків.
Вільна волога – це волога, не зв’язана полімерами і доступна для перебігу біохімічних і мікробіологічних реакцій.
Наприклад, вологість зерна складає 15-20%, а частка зв’язаної вологи при цьому дорівнює 10-15%.
Плоди та овочі мають вологість 75-95%.
В основному це вільна волога; частка зв’язаної приблизно 5%. Тому овочі і плоди легко висушувати до 10-12%..
Більша частина води в продукті може бути перетворена в лід при - 5°С, а вся при - 50°С і нижче.
«Гідратація» і «Зв’язування води» - визначення, що характеризують здатність води до асоціації з різним ступенем міцності з гідрофільними речовинами. Розмір і сила зв’язування залежать від природи неводного компоненту, рН, температури і інше.
Розкриємо поняття «зв’язана волога». Вона:
- не замерзає при - 40°С і нижче;
- не може служити розчинником при додаванні речовини;
- має щільність у 2 рази більшу щільності вільної вологи;
- не видаляється із продукту при висушуванні;
- недоступна мікроорганізмам.
Зв’язана волога згідно класифікації акад.. Ребіндера П.А. поділяється на три групи:
- хімічно зв’язана;
- фізико-хімічно зв’язана;
- механічно зв’язана.
При цьому визначальною є енергія зв’язків.
За величиною енергії зв’язків розрізняють чотири форми зв’язків вологи:
- хімічно зв’язана;
- адсорбційно зв’язана;
- осмотично зв’язана;
- капілярно зв’язана – механічно зв’язана.
Хімічно зв’язана волога – має найбільшу енергію звязку і представляє воду зв’язану у вигляді гідроксильних іонів (NaOH), конструкційну воду кристалогідратів (CuSO4 ×5H2O). Цей зв'язок можна зруйнувати або шляхом хімічної дії, або нагріванням до високих температур – прокалюванням.
Адсорбційно зв’язана волога утворюється при взаємодії молекул адсорбенту і молекул води.
Більшу частину адсорбційно звязаної вологи у живих тканинах м’ясопродуктів складає вода, яка утворює сольватну оболонку молекул білкових речовин і гідрофільних колоїдів.
Осмотичн озвязана волога є вільною, оскільки їй відповідає дуже мала енергія зв’язку.
Волога поглинається без виділення тепла і стискання системи. Осмотично зв’язана волога дифундує в середині тіла у вигляді рідини через стінки клітин завдяки різниці концентрації в клітині і поза нею.
Для руйнування адсорбційно і осмотично зв’язаної вологи потрібно набагато менше енергії, ніж при хімічній формі зв’язку. Видалення такої вологи відбувається у вигляді пари, тобто необхідно попередньо воду перевести у пару.
Капілярно звязана волога - ця волога знаходиться у капілярах (порах). Капілярна волога може рухаєтись як у вигляді рідини, так і вигляді пари.
Ця форма зв’язку має найменшу енергію зв’язку. ЇЇ можна видаляти шляхом механічного впливу (наприклад, пресуванням, центрифугуванням).
В харчових продуктах є вода яка утворюється макромолекулярною матрицею. Наприклад, гелі пектину і крохмалю, рослинні і тваринні тканини при невеликих їх кількостях можуть утримувати значну кількість води.
Структура цієї води в клітинах і макромолекулярній матриці точно не встановлена, її поведінка і важливість для якості харчових продуктів очевидна. Ця вода не видаляється із харчового продукту навіть при великому механічному зусиллі. З іншої сторони, в технологічних процесах обробки поводить себе майже як чиста вода. Наприклад, її можна видалити при висушуванні або перетворити у лід при заморожуванні. Таким чином, властивості цієї води, як вільної, дещо обмежені, але її молекули ведуть себе подібно молекулам розбавлених сольових розчинів.
Саме ця вода складає головну частину води у клітинах і гелях, і зміни її кількості суттєво впливають на якість харчових продуктів.
Наприклад, зберігання гелів часто призводить до погіршення їх якості із-за втрат цієї води (так званий «синерезис»).
Для характеристики стану вологи в продукті використовують показник активність води (аw).
Відомо, що існує взаємозв’язок між вмістом вологи у харчових продуктах і їх здатністю до зберігання. Тому основним методом подовження термінів зберігання харчових продуктів завжди було зменшення вмісту вологи шляхом концентрування чи дегідратації.
Однак, часто різні харчові продукти з одинаковою вологістю псуються по різному. Було установлено, що має значення наскільки вода асоційована з неводними компонентами: чим міцніше зв’язана вода, тим вона менше підтримує процеси, що руйнують харчовий продукт, також мікробіологічні і гідролітичні процеси.
Щоб урахувати цей фактор було введено термін «активність води».
Активність води – це відношення тиску пари над даним продуктом до тиску пари над чистою водою при тій же температурі. Це відношення входить в основу термодинамічну формулу визначення енергії зв’язку вологи з матеріалом (рівняння Ребіндера):
∆F = L = RT*lnPo/Pw = - RT*lnaw,
де ∆F – зменшення вільної енергії (при t = cont);
L – робота відриву 1 моля води від сухого скелета матеріалу;
R – універсальна газова стала.
Aw = Pw/Po = POB/100,
де Pw – тиск водяної пари в системі харчового продукту;
Po – тиск пари чистої води;
POB – відносна вологість у стані рівноваги при якій продукт не вбирає вологу і не втрачає її в атмосферу, %.
За величиною активності води продукти поділяють:
- продукти з високою вологістю (aw = 1,0 – 0,9);
- продукти з проміжною вологістю (aw = 0,9-0,6);
- продукти з низькою вологістю (aw = 0,6-0,0)
Активність води (aw) у харчових продуктах
| Продукт | Вологість, % | а,w | Продукт | Вологість, % | а,w |
| Фрукти | 90-95 | 0,97 | Борошно | 16-19 | 0,80 |
| Яйця | 70-80 | 0,97 | Мед | 10-15 | 0,75 |
| М'ясо | 60-70 | 0,97 | Карамель | 7-8 | 0,65 |
| Сир | 0,92-0,96 | Печиво | 6-9 | 0,60 | |
| Джем | 30-35 | 0,82-0,94 | Шоколад | 5-7 | 0,40 |
| Хліб | 40-50 | 0,95 | Цукор | 0-0,15 | 0,10 |
| Кекс | 20-28 | 0,95 |
Роль льоду у зберіганні харчових продуктів
Заморожування є найбільш розповсюдженим способом зберігання харчових продуктів.
При цьому необхідний ефект досягається не за рахунок утворення льоду, а за рахунок впливу низьких температур.
Утворення льоду у клітинних структурах харчових продуктів і гелях має два важливих наслідки: а) неводні компоненти концентруються в незамерзаючій фазі (незамерзаюча фаза існує у харчових продуктах при усіх температурах зберігання); б) вся вода, що перетворюється у лід, збільшується у об’єм на 9%.
Під час заморожування вода переходить у кристали льоду. Тому всі неводні компоненти концентруються у зменшеній кількості незамерзаючої води. Завдяки цьому ефекту незамерзаюча фаза суттєво змінює рН, титровану кислотність, в’язкість, іонну силу, точку замерзання, поверхневий натяг, окисно-відновний потенціал.
Таким чином заморожування має два протилежних впливи на швидкість реакцій: - низька температура буде зменшувати її, а концентрування компонентів у незамерзаючій фазі – збільшувати. Останній чинник слід враховувати при зберіганні продуктів, оскільки він буде впливати на якість.
Дата добавления: 2015-08-26; просмотров: 1132;
