Продуктах
До методів визначення кислот відносяться стандартні методи: колориметричний і електрометричний.
Визначення потенційної кислотності основане на титруванні цих речовин лугом.
Для різних харчових продуктів характерні свої особливі умови титрування результати яких подають у відповідних кислотних числах.
Аналіз кислотного складу харчового продукту дає можливість виявити фальсифікацію чи підтвердити натуральність.
Органічні кислоти визначають стандартними і альтернативними методами.
Так, молочну кислоту визначають шляхом її окиснення перманганатом калію до оцтового ангідриду, який визначається йодометрично.
Винну кислоту визначають лужним титруванням винного каменю, що випадає в осад.
Більшість органічних кислот можна визначити хроматографічним методом.
До альтернативних відносяться методи основані на використанні ферментативних систем. Особливості цього методу є специфічність, яка забезпечує достовірність, точність результатів і чутливість.
Питання для самоперевірки
1. Дайте загальну характеристику кислот, що входять до складу харчових продуктів.
2. Наведіть приклади речовин, що використовуються у харчовій промисловості для регулювання рН харчових систем.
3. В яких технологічних функціях проявляється дія органічних кислот у харчових системах?
4. Які особливості органічних кислот, що використовуються у харчових цілях?
5. Приведіть приклади біохімічних змін кислотності харчової системи.
6. Дайте коротку характеристику методів, які дозволяють визначити кислоти у складі продуктів.
7. На які технологічні параметри впливає величина рН?
Рекомендована література
Основна:
1. с.263 – 275
Тема 7
роль Ферментів та ферментних препаратів у
харчових технологіях
План
1. Класифікація ферментів, їх властивості
2. Фактори, що впливають на кінетику ферментативних реакцій
3. Основні біохімічні перетворення у харчових технологіях
4. Ферментні препарати, їх характеристика
5. Застосування ферментних препаратів у харчових технологіях
1. Класифікація ферментів, їх властивості
Ферменти – це біологічні каталізатори білкової природи. Вони значно перевищують швидкість хімічних реакцій. Вступаючи в біохімічні реакції, ферменти не витрачаються і не зазнають незворотних змін.
Ферментативну реакцію можна представити таким рівнянням:
Е + S ÛES → P + E,
де Е – фермент, S – субстрат, ЕS – фермент-субстратний комплекс, Р – продукт реакції.
Ферменти як білкові речовини часто зв’язані з небілковим компонентом – коферментом, який бере участь у дії ферменту. Коферментом можуть бути вітаміни, їх похідні та інші речовини.
Класифікація ферментів
| Клас | Назва класу | Реакціі, що каталізуються |
| Оксидоредуктази | Окисно-відновні реакції (приєднання О2, відщеплення та перенесення Н2) | |
| Трансферази | Перенесення атомних груп з однієї сполуки на іншу | |
| Гідролази | Реакції гідролізу | |
| Ліази | Реакції негідролітичного відщеплення або приєднання груп по місцю подвійного зв’язку | |
| Ізомерази | Реакції ізомерації |
Харчові технології є, по-суті, біотехнологіями, оскільки одними з найбільш важливих процесів є мікробіологічні та біохімічні. Біохімічні процеси, що мають місце під час зберігання сировини та під час перебігу технологічних процесів, пов'язані з дією природних, власних ферментів харчової сировини, ферментів мікроорганізмів, а також ферментів, які вносяться у напівфабрикати у вигляді ферментних препаратів.
Особливіості ферментів порівняно з неорганічними каталізаторами:
1. Вони значно, в 108– 1020, підвищують швидкість реакцій, що каталізуються;
2. Дія ферментів є специфічною, тобто, вони каталізують лише певні реакції і можуть діяти на один субстрат, на групу споріднених субстратів, або на певні зв'язки, або на певні стереохімічні форми субстратів;
3. Ферменти як біологічні каталізатори є лабільними, тобто вони змінюють свою активність під впливом рН середовища, температури, вологості, присутності активаторів чи інгібіторів.
2. Фактори, що впливають на кінетику
ферментативних реакцій
Швидкість реакції залежить від:
1. Концентрації субстрату. Максимальна швидкість ферментативної реакції спостерігається при такій концентрації субстрату, коли всі активні центри ферменту насичені субстратом і перейшли в комплекс ES. Тобто, до певної межі збільшення концентрації субстрату сприяє зростанню швидкості реакції, а подальше збільшення концентрації не впливає на кількість продуктів реакції. При дуже високих концентраціях субстрат може навіть виконувати роль інгібітора.
2. Концентрації ферменту. Вона має суттєвий вплив на швидкість ферментативних реакцій. У разі насиченої концентрації субстрату, при якій V 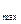 , початкова швидкість ферментативної реакції залежить від концентрації ферменту. Тобто, у разі надлишку субстрату швидкість тим вища, чим вища концентрація ферменту.
, початкова швидкість ферментативної реакції залежить від концентрації ферменту. Тобто, у разі надлишку субстрату швидкість тим вища, чим вища концентрація ферменту.
3. Природи субстрату та його атакованості. Атакованістю називають піддатливість субстрату до дії ферменту. Вона залежить від структури, розмірів молекули тощо. Наприклад, атакованість крохмалю амілазами залежить від розміру крохмальних зерен (чим він менший, тим більша атакованість, оскільки більша площа контакту субстрату і ферменту), від механічної зруйнованості (механічно пошкоджені крохмальні зерна мають вищу атакованість), клейстеризований крохмаль має вищу атакованість. Атакованість білка залежить від щільності білкової молекули, наявності –SH груп – чим їх більше, тим значніша атакованість.
4.Найбільш суттєвий вплив на активність ферментів має температура і рН середовища.
З підвищенням температури активність ферменту збільшується, досягає максимуму, а потім знижується. Оптимальна температура для більшості ферментів 40-50°С. Зниження активності ферментів при високій температурі є наслідком денатурації білка. Проте є термофільні ферменти, які мають значно вищий температурний оптимум і зберігають деяку активність навіть при нагріванні вище 100°С (наприклад, a- амілаза). Кожний фермент проявляє свою активність при різних межах рН. Деякі ферменти мають найбільшу активність у кислому середовищі, інші – у нейтральному чи лужному.
Параметри зони оптимуму дії основних ферментів зернових культур
| Фермент | рН | Температура, ºС |
| a-амілаза | 5,6...6,3 (кислотолабільна - інактивується при рН=3,3...4,0) | термостабільна (зберігає активність при 90ºС) |
| β-амілаза | 4,5...4,8 (кислотостабільна - зберігає активність при рН=3,3) | термолабільна (інактивується при температурах більше 60ºС) |
| Протеїназа | 4,0...4,8 | 40...50 |
| Ліпаза | 7,5...8,5 | 60...80 |
| Ліпоксигеназа | 6,0...7,0 | 20...30 |
| Поліфенолоксидаза | 5,0...7,0 | 40...50 |
| Целюлаза | 4,3...4,7 | 30...40 |
5.Швидкість ферментативних реакцій залежить від присутності активаторів. Цистеїн, глютатіон, які містять сульфгідрильні групи, є активаторами ферментів. Активуюча дія їх ґрунтується на тому, що вони відновлюють дисульфідні групи ферменту в сульфгідрильні, які є необхідними для відновлення ферментативної активності. При цьому самі активатори окислюються.
Інгібіторами ферментів можуть бути солі важких металів (Pb, Hg та ін.), трихлороцтова кислота тощо.
3.Основні біохімічні перетворення у харчових технологіях
У харчових технологіях основну роль відіграють гідролази та оксидоредуктази:
§ гідролази (гідролітичні ферменти) – ліпази, пектинестераза, амілази, b- галактозидаза, b- фруктофуранозидаза, протеїнази, целюлолітичні ферменти;
§ оксидоредуктази: поліфенолоксидаза, ліпоксигеназа, каталаза, пероксидаза.
.
Під час зберігання сировини ферменти беруть участь у:
§ гідролітичних процесах;
§ процесах дихання;
§ автолізі.
Значення гідролітичних процесів у харчових технологіях
Під час зберігання сировини гідролітичні процеси можуть викликати покращення якості або псування в залежності від умов зберігання. Наприклад, при зберіганні зимових сортів яблук, груш відбувається покращення їх смаку. Це пов¢язано з гідролізом крохмалю та з накопиченням цукрів, гідролізом пектинових речовин. Псування зерна відбувається при проростанні. Під час проростання ферменти активізуються, оскільки вони переходять із зв¢язаного стану у вільний стан.
Протеолітичні ферменти (протеази)
Білки підлягають хімічному (під дією кислот та лугів) та біохімічному (ферментативному) гідролізу. Кислотний та лужний гідроліз білків (розглянуто у темі 1) здійснюється при кип’ятінні з міцними кислотами та лугами. Кислотний та лужний гідроліз здійснюється в технологіях отримання білкових концентратів та ізолятів для переведення білків у розчинний з наступним виділенням білків з розчину шляхом висолювання. Підвищення кислотності тіста веде до часткової пептизації білків, тобто переходу їх у водорозчинний стан. Це може бути небажаним у разі перероблення борошна зі зниженими технологічними властивостями.
Ферментативний гідроліз білків здійснюється під дією протеаз, ферментів, які каталізують розрив пептидних зв’язків. Протеази поділяються на:
§ пептидази, які діють на пептидні зв’язки поліпептидів, гідролізуючи їх з утворенням амінокислот (екзопептидази);
§ протеїнази(папаїн, пепсин, трипсин), які діють на пептидні зв’язки білків, при цьому вони розщеплюють молекули білка на більш дрібні фрагменти, тобто під дією протеїназ відбувається лише деструкція білкової молекули (ендопептидази).
Вважається, що екзопептидази не можуть гідролізувати в середині молекули, а діють з карбоксильного чи з амінного кінця білкової молекули, відщеплюючи послідовно по одній молекулі амінокислоти.
Пептидази мають кислотний оптимум рНопт = 8 – 9, тому вони в тісті мало утворюють амінокислот.
Рослинні протеїнази є кількох типів:
- кислі з рНоп = 3,7 – 4,0;
- нейтральні з рНоп = 6,5 – 7,0;
- лужні з рНоп>8.
Найбільшої уваги заслуговують нейтральні протеїнази, оскільки вони в декілька разів активніші кислих протеїназ і в умовах тіста суттєво впливають на білки клейковини. У дозрілому зерні пшениці нейтральні протеїнази та їх білкові інгібітори утворюють неактивний комплекс, зв’язаний з клейковиною. Співвідношення активності протеїназ у зерні та їх інгібіторів визначає стабільність білкового комплексу, його поведінку під час тістоприготування. До активаторів кислих протеїназ відносяться глютатіон та цистеін, але нейтральні протеїнази не активуються глютатіоном та цистеїном. Нейтральні протеїнази знижують свою активність в присутності хлориду натрію, фенольних сполук, меланоїдинів. У залежності від активності протеїназ і стану клейковинного комплексу можна змінювати кількість та стадію внесення солі і цим самим впливати на активність протеолізу. Наприклад, під час перероблення борошна зі слабкого клейковиною її треба вносити якомога раніше наприклад, сіль в опару і в трохи більшій кількості, а у разі надмірно міцної клейковини сіль потрібно вносити на більш пізніх стадіях.
Ферментативний гідроліз білків має важливе значення в інших харчових технологіях.
Пепсин (кисла протеїназа) використовується для одержання казеїну молока і для розчинення білкової мутності у вині.
Реннін (схожий на пепсин) міститься в соці четвертого відділу шлунка телят, являє собою дуже потужну протеїн азу.
Поряд з рослинними та тваринними протеазами у харчових технологіях широко застосовуються протеази мікробного походження (грибні та бактеріальні).
Амілази
Ферментативний гідролізкрохмалювідбувається під дією амілолітичних ферментів a- і b-амілази, глюкоамілази та деяких інших.
a-амілаза є ендоамілазою, тобто вона може розривати внутрішньо-молекулярні зв’язки в будь-якому місці. Діючі на крохмалеві зерна, a-амілаза ніби розщеплює зерно, утворює на поверхні канали і бороздки. Клейстеризований крохмаль гідролізується з утворенням низькомолекулярних незабарвлюваних йодом декстринів, які дуже повільно гідролізуються a-амілазою до мальтози і глюкози.
крохмаль ® a -декстрини + мальтоза + глюкоза
b-амілаза є екзоамілазою, яка відщеплює від амілози і амілопектину мальтозу з нередукуючого кінця, діє лише на a-Д – 1,4 зв’язок. Нативні крохмальні зерна b-амілазою не гідролізуються. Клейстеризований крохмаль гідролізується на 54-58% до мальтози і 42-46% утворює b-декстринів.
крохмаль ® мальтоза + b декстрини
Глюкоамілаза a–1,4 глюканглюкогідролаза є екзоферментом, який каталізує послідовне відщеплення a-Д –глюкози від нередукеруючого кінця крохмального ланцюга. Особливістю цього ферменту є здатність швидко гідролізувати полімери, але дуже повільно ди-та олігосахара. Останніми роками у технології виробництва патоки поєднують кислотний і ферментативний гідроліз. Ферментативний гідроліз крохмалю має місце під час виготовлення пива та спирту.
Дата добавления: 2015-08-26; просмотров: 1198;
