Ковалентная (гомеополярная) или атомная связь
Осуществляется с помощью спаренных электронов. В образовании электронной пары принимают участие оба атома, отдавая по одному электрону.
Ковалентная связь строго направлена, её сила зависит от числа спаренных электронов и их энергетического уровня.
Число связей (или спаренных электронов) обусловлено стремлением атомов обрести устойчивую 8-ми электронную оболочку. Каждый атом связан с (8 – N) атомами, где N – порядковый номер его группы в таблице Менделеева.
Наиболее выраженную атомную связь имеют элементы 4-й группы: углерод, кремний, германий. Для структур характерны малые координационные числа, отсутствие плотнейших упаковок. Пример: структура алмаза с координационным числом 4, каждый атом углерода с 4-мя ближайшими атомами связан ковалентно. Все связи направлены по ребрам кубического тетраэдра.
Чем ниже в таблице Менделеева распложен атом 4-й группы, тем его тенденция к ковалентному типу связи ослабевает и усиливается тенденция к металлическому типу: C (ковалентная), Si (ковалентная), Ge (ковалентная) Sn (серое олово – ковалентная, белое олово – металлическая), Pb (металлическая).
Ковалентная связь очень прочная, поэтому кристаллы имеют высокие значения твердости (алмаз, карборунд), температуры плавления, проводимость колеблется в широких пределах: от хороших проводников до диэлектриков.
Очень часто связи бывают не чисто ионные или ковалентные, а имеют ионно-ковалентный характер.
Ковалентная связь образуется не только между однородными атомами, но и между разнородными. Например, элементы 3-й группы таблицы Менделеева (B, Al) соединяясь с элементами 5-й группы(N, P, As ) образуют полупроводниковые соединения типа А3В5, где А – катион, В – анион, 3,5 – индексы, которые соответствуют номеру столбца в таблице Менделеева.
В таких соединениях имеется доля ионной связи, которая рассчитывается по электроотрицательностям взаимодействующих атомов. При взаимодействии разнородных атомов существенна их способность захватывать или отдавать электроны, что характеризуется величиной называемой электроотрицательностью 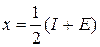 ,
,
где: I- потенциал ионизации – энергия, которую надо сообщить атому, чтобы оторвать внешний электрон;
Е – сродство к электрону, т. е. энергия присоединения.
Если электроотрицательности атомов равны или очень близки, то связи ковалентные, а если сильно отличаются то связи – ионные.
Так, кислородные соединения кремния содержат силоксановую связь Si – O, процент доли ионной связи, вычисленный по отношению электроотрицательностей ионов Si4+ и O2- составляет ≈ 50% , связи Al – O в α-Al2O3 – 41%, связи Ті – О в ТіО2 – 40%.
Дата добавления: 2015-06-27; просмотров: 1252;
