И его зависимость от состава дисперсионной среды и поглощенных оснований
Коллоидные частицы окружены прочно связанными с ними водными пленками или, как говорят, коллоидные частицы гидратированы.
Присоединение молекул воды к коллоидной частице связано с проявлением поляризационных сил. С приближением к заряженной коллоидной частице электронная оболочка молекул воды деформируется (раздвигается центр тяжести положительного и отрицательного зарядов) и, хотя молекула воды остается нейтральной, она приобретает форму диполя.
Образовавшиеся диполи, попадая в сферу электрического поля заряженной частицы, приобретают строгую ориентировку, обращаясь к ней концами, несущими заряд, противоположный заряду частицы, причем притягивается, таким образом, не только первый слой молекул, но и второй и третий. Вокруг частицы образуется прочно связанная с нею водная пленка. Мощность этой пленки может быть различна и зависит от природы коллоида и величины заряда частицы (рис. 9.2).
Коллоиды, способные сильно гидратироваться (т. е. удерживающие мощные водные пленки), называются гидрофильными. Коллоиды, слабо гидратирующиеся, называются гидрофобными. Свойство гидрофильности или гидрофобности коллоидов помимо их химической природы зависит от состава поглощенных ионов.
Коллоиды могут находиться в состоянии золя, т. е. взвесей, или в виде студнеобразного осадка — геля.
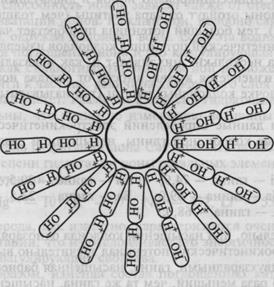
Рис. 9.2. Ориентированные диполи воды вокруг гидратированной частицы
Переход коллоида из состояния золя в состояние геля называется коагуляцией (или свертыванием), а обратный переход из геля в золь — пептизацией.
Переход коллоидов из одного состояния в другое обусловлен главным образом изменением электрического потенциала коллоидных частиц и зависит от степени их гидратации. При повышении потенциала (увеличении заряда частиц) происходит пептизация коллоида — переход его в золь. Одноименно заряженные коллоидные частицы, отталкиваясь друг от друга, могут неопределенно долгое время находиться в растворе, не укрупняясь и не образуя осадка.
При падении потенциала и потере заряда (частичной или полной) состояние коллоидов в форме золя делается неустойчивым. При движении частицы сталкиваются друг с другом, склеиваются, увеличиваются в размерах -и, образуя хлопья, выпадают в осадок, увлекая вместе с собой окружающие их водные пленки. Получается рыхлый, насыщенный водой студнеобразный осадок или гель, по высыхании превращающийся в аморфный тонкий порошок.
Рассмотрим, какие причины вызывают изменение потенциала коллоидных частиц. Напомним, что понятие о знаке и величине заряда коллоидов относится не к мицелле в целом, а лишь к частице, т. е. к части мицеллы без диффузного слоя. Следовательно, чем больше будет отдиссоциировано ионов в диффузный слой и чем дальше эти ионы отойдут от ядра частицы (чем толще будет диффузный слой), тем больший потенциал приобретает частица.
Электрокинетический потенциал коллоидов измеряется величинами порядка нескольких милливольт и, как показали измерения, значительно изменяется в зависимости от состава ионов, находящихся в оболочке коллоидных частиц (так называемых поглощенных ионов).
Приведем данные определений электрокинетического потенциала (мВ) для коллоидной глины, насыщенной различными катионами:
Li — глина — 74,9; Са — глина — 30,5;
Na — глина — 69,0; Ва — глина — 22,5.
К — глина — 68,0;
Следовательно, при насыщении коллоида однозарядными катионами электрокинетический потенциал значительно выше, чем при насыщении двухзарядными: глина, насыщенная барием, имеет потенциал в 3,3 раза меньший, чем та же глина, насыщенная литием. Чем больше заряд иона, тем с большим трудом и на меньшее расстояние происходит его отдиссоциация от коллоидной частицы. При насыщении коллоидов трехзарядными ионами степень диссоциации и потенциал частицы еще более падают.
Таким образом, при насыщении однозарядными катионами коллоиды преимущественно находятся в состоянии золя, а при замене однозарядных катионов двух- и трехзарядными переходят в гель. Все катионы, как показал К. К. Гедройц, по энергии их поглощения (трудности вытеснения) и коагулирующей способности можно расположить в определенный ряд, названный им лиотропным, в котором ионы располагаются в таком порядке:
Li+ < Na+ < NH4+< К+ < Mg2+ < Н+ < Са2+ < Ва2+ < А13+ < Fe3+
Энергия поглощения ионов и их коагулирующая способность увеличиваются с увеличением зарядности, а в пределах группы ионов с одинаковой зарядностью — с увеличением атомного веса. Так, атомный вес Li — 7, Na - 23, К — 39, Mg — 24, Са — 40, Ва — 137, А1 - 27, Fe - 56.
Исключение представляет одновалентный ион водорода, который стоит среди двухзарядных Mg и Са, обладая наименьшей среди ионов атомной массой, равной единице. Объяснить это исключение можно следующим образом.
Кроме зарядности и атомного веса, энергия поглощения и коагулирующая способность ионов зависят также от степени гидратации или сольватации ионов. Каждый ион, подобно самой коллоидной мицелле, окружен диполями воды. Если эта водная пленка велика, энергия поглощения иона и его коагулирующая способность падают, так как сильногидратированный ион не может достаточно близко подойти к частице: величина диффузного слоя увеличивается и потенциал растет. Различия в степени гидратации ионов весьма значительны, что видно по изменению величины их радиусов (табл. 9.2).
Если степень гидратации иона Са2+ принять за 100, то по относительной степени гидратации ионы остальных элементов расположатся в следующий ряд:
Mg2+ - 101, К+ - 178, Na+ - 452, Li+ - 552.
Ион водорода, как известно, характеризуется очень малой степенью гидратации, что и обусловливает его энергичное поглощение и хорошие коагулирующие свойства.
Таким образом, изменяя состав поглощенных катионов путем соответствующего регулирования состава и концентрации солей в Дисперсионной среде, можно переводить коллоиды из состояния золя в состояние геля и обратно.
Таблица 9.2
Дата добавления: 2015-06-27; просмотров: 1091;
