Строение почвенных коллоидов
Физико-химическая, или обменная поглотительная, способность состоит в том, что почва способна обменивать некоторую часть катионов (или анионов), находящихся на поверхности твердых частиц, на эквивалентное количество катионов (или анионов), находящихся в растворе, соприкасающемся с этими частицами. Это явление называется физико-химической адсорбцией, при которой в отличие от физической поглощаются не целые молекулы, а отдельные ионы (катионы или анионы). Оно связано с наличием на поверхности коллоидных частиц положительного или отрицательного потенциал - определяющего электрического заряда.
Вследствие наличия на поверхности коллоидных частиц заряда Распределение ионов в растворе вблизи каждой частицы происходит не только в результате молекулярного теплового движения, но и под влиянием электростатических сил, притягивающих противоположно заряженные ионы к твердой частице. В результате образуется двойной электрический слой, внутреннюю обкладку которого образуют потенциалобразующие ионы, а внешнюю — компенсирующие ионы противоположного заряда. Силы молекулярного теплового движения стремятся распределить ионы в растворе равномерно.
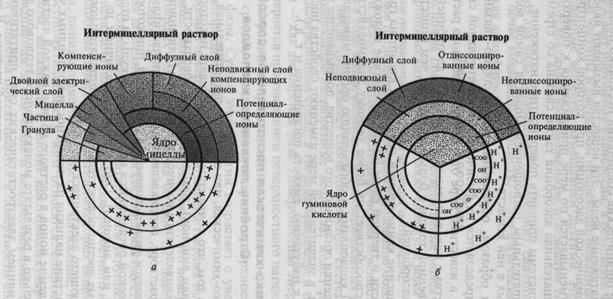
В результате этих противоположно действующих сил (электростатических и теплового движения) вокруг твердых коллоидальных частиц в растворе устанавливается равновесие, аналогичное изменению плотности газа под влиянием силы тяжести. Концентрация ионов с зарядом, противоположным заряду частиц, убывает по мере удаления от ее поверхности, уменьшается в этом направлении и связь ионов с частицей. Непосредственно около заряженной частицы, на поверхности которой находится слой потенциалопределяющих ионов, концентрируется наиболее прочно связанный с частицей неподвижный слой адсорбированных компенсирующих ионов.
Часть ионов противоположного заряда удалена от частицы и находится в пределах окружающей коллоидную частицу ионной атмосферы. Это диффузный слой ионов. На определенном расстоянии от твердой частицы, где сила электростатического притяжения оказывается равной силе теплового движения ионов, концентрация ионов с различными зарядами выравнивается. Это расстояние определяет толщину диффузного слоя.
Таким образом, коллоид имеет сложное строение (рис. 9.1). Его внутренняя часть, состоящая из агрегата молекул аморфного или кристаллического вещества, называется ядром. Ядро с потенциал- определяющим слоем ионов на поверхности называется гранулой, а гранула вместе со слоем неподвижных противоионов — частицей, а если сюда присоединить еще и слой диффузных противоионов — мицеллой.
Знак заряда твердых частиц приблизительно может быть определен правилом Коэна, согласно которому твердое тело получает отрицательный заряд, если его диэлектрическая постоянная меньше диэлектрической постоянной соприкасающейся с ним жидкости. Диэлектрическая постоянная чистой воды равна 81, а большинства минералов — 5—6, что и обусловливает их преимущественно отрицательный заряд.
Если ядро мицеллы состоит из кристаллического вещества, появление заряда на его поверхности может быть следствием разрушения кристаллической решетки и появления на поверхности остаточных некомпенсированных связей.
Отрицательный заряд у коллоидов глинистых минералов появляется вследствие изоморфного замещения в кремнекислородных тетраэдрах Si4+ на А13+, а в алюмокислородных октаэдрах — части Al 3+ на Mg 2+ кристаллов. Кроме того, заряд может появляться вследствие нарушения связей на поверхности кристаллов в пластинчатых кристаллах на боковых (торцовых) поверхностях.
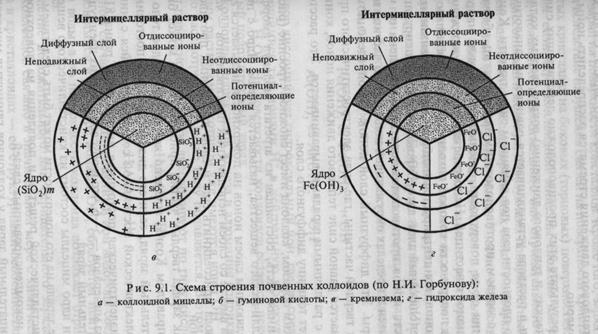
В случае если ядро коллоидной мицеллы сложено аморфным веществом, появление положительного или отрицательного заряда связано с диссоциацией молекул, образующих поверхностный слой, и удалением одного из отдиссоциированных ионов с поверхности в слой неподвижных или диффузных ионов. Участие отдиссоциированного иона в обменных химических реакциях, в результате которых образуются менее диссоциированные и менее растворимые соединения, способствует образованию связанного с ядром слоя некомпенсированных ионов, определяющих заряд коллоида. Так, коллоиды гидроксидов железа Fe(OH)3 и алюминия А1(ОН)3 в кислой среде при наличии в растворе ионов водорода Н+ заряжаются положительно благодаря диссоциации молекул, находящихся на поверхности, по следующему типу:
Fe(OH)3 <=> Fe(OH)2+ + ОН"
А1(ОН)3 <=> А1(ОН)2+ + ОН-
В раствор диссоциирует гидроксильный ион, где он соединяется с имеющимися там ионами Н+ в нейтральную молекулу воды (Н+ + ОН —» Н2O). На поверхности коллоидов остается некомпенсированный положительный заряд.
Если коллоиды гидроксидов железа и алюминия соприкасаются с щелочным раствором, в котором уже имеются ионы ОН", диссоциация по рассмотренному выше типу подавляется. В этом случае молекулы поверхностного слоя диссоциируют по типу кислот:
H3FeO3 <=> H2FeO3- + Н+
Н3А1O3 <=> Н2А1O - + Н+
В данном случае отдиссоциированный ион водорода соединяется с имеющимися в растворе ионами ОН; образуется нейтральная молекула воды, а на поверхности коллоида возникает отрицательный заряд.
Появление положительного или отрицательного заряда у различных коллоидов связано в значительной мере с химическим составом, а в кристаллоидах — со структурными особенностями коллоидального вещества.
Коллоидальный кремнезем в щелочной среде обычно имеет отрицательный заряд, так как диссоциация поверхностных молекул SiO2 • H2O идет по типу Н+ — HSi03-, отдиссоциированный водород соединяется с ОН- растворов в молекулу воды, на поверхности ядра остается отрицательный заряд. В сильнокислой среде диссоциация Н+ подавляется и коллоид становится электронейтральным. Так же ведут себя и коллоиды гумусовых веществ, представляющих, как было показано ранее (см. гл. 8), сложные высокомолекулярные многоосновные органические кислоты.
Коллоиды гуминовых кислот имеют отрицательный заряд вследствие диссоциации части водорода карбоксильных (СООН) и фенолгидроксильных (ОН) групп: — (СОО-) — Н+, — (О-) — Н+.
В кислой среде при подавлении диссоциации водорода (уже имеющимися в растворе ионами водорода) коллоид гуминовой кислоты становится электронейтральным.
Коллоиды, имеющие в. потенциалопределяющем слое отрицательный заряд, называются ацитоидами если заряд потенциалопределяющего слоя положительный, коллоиды относятся к группе 6азоидов; если же он может изменяться при разных кислотно-щелочных условиях среды (как, например, в случае гидроксидов железа и алюминия), коллоиды принадлежат к группе амфолитоидов.
Расположенные в поле электростатического воздействия заряда противоионы (катионы в случае отрицательно заряженных, анионы — в случае положительно заряженных коллоидов) могут участвовать в реакциях обмена на ионы того же знака, находящихся в межмицеллярном растворе. Обмен ионами идет в эквивалентных количествах; одни из них поглощаются и исчезают из межмицеллярного раствора, взамен им появляются другие, находящиеся в диффузном слое и слое неподвижных противоионов коллоидной мицеллы. Эти явления получили название физико-химического поглощения и обмена.
От обычных реакций химического обмена эти реакции отличаются тем, что идут лишь на поверхности коллоидов и не затрагивают молекулы, образующие внутренность ядра коллоида, т. е. реакции, осуществляются между твердой частицей и раствором.
Дата добавления: 2015-06-27; просмотров: 1834;
