Другие примеры использования полимерных носителей
Кроме рассмотренных выше примеров в настоящем разделе представляет интерес рассмотреть некоторые вопросы, связанные с иммобилизацией на полимерных носителях сложных объектов биологического, биохимического или микробиологического назначения. К таким объектам отосятся, прежде всего, макромолекулы белков, выполняющих различные функции. Кроме вопросов присоединения к носителям белковых макромолекул в настоящем разделе очень кратко рассмотрены принципы иммобилизации на носителях живых клеток.
Белки представляют собой высокомолекулярные соединения, макромолекулы которых построены из звеньев 22 природных a-аминокислот, соединенных между собой пептидной связью и расположенных вдоль цепи в определенной, характерной для каждого белка последовательности.
В организме белки выполняют самые разнообразные функции, но практически все они являются биологическими катализаторами — ферментами. Вещества, которые под действием ферментов подвергаются химическим превращениям, называются субстратами. Именно ферментативная способность белков определяет возможность протекания в организме сложнейших биохимических превращений в очень мягких условиях.
Макромолекулы ферментов представляют собой сложнейшие молекулярные “устройства”, различные части которых играют разную роль в реализации актов ферментативного катализа. Все они имеют в своей структуре связывающий центр, осуществляющий формирование фермент-субстратного комплекса за счет слабых взаимодействий различной природы, и активный центр, собственно и осуществляющий акт ферментативного катализа.
Макромолекулы белков в большом числе случаев представляют собой линейные полипептидные цепи, имеющие концевые карбоксильные и аминогруппы. Кроме них молекулы белков могут иметь множество других функциональных групп, принадлежащих боковым радикалам аминокислот — гидроксильных, фенольных, амино- и амидных, карбоксильных, сульфгидрильных и некоторых других. Значительная их часть расположена во внутренних областях макромолекулярного клубка или глобулы, формируя и стабилизируя вторичную и третичную структуры макромолекулы. Некоторое количество функциональных групп находится во внешних областях макромолекулы. Именно эти группы и участвуют в формировании связывающего и активного центров. За счет реакций этих функциональных групп может реализоваться иммобилизация белковых макромолекул на полимерных носителях.
Носители для иммобилизации белков имеют cвои особенности, которые связаны главным образом с большим размером макромолекул иммобилизуемых ферментов. Поэтому основным типом используемых для этой цели носителей являются слабо сшитые гели, в массу которых могут диффундировать крупные молекулы белков. Кроме требования по параметрам сетки, допускающим проникновение в нее белковых молекул, носители должны отвечать еще целому ряду требований — обладать достаточной гидрофильностью (все ферментативные реакции реализуются в водных средах), иметь функциональные группы для образования ковалентных связей с белками, не взаимодействовать с белковыми молекулами таким образом, чтобы это могло повлечь потерю последними ферментативной активности.
Одним из наиболее распространенных носителей для ковалентного присоединения к нему белков является сефароза, представляющая собой сферические частицы геля агарозы — полисахарида, выделяемого из водорослей агар-агар. Для реализации образования ковалентной связи между гидроксильными группами сефарозы и функциональными группами белковой макромолекулы используется множество методов, но шире других два — бромциановый и метод с использованием глутарового диальдегида:
а) бромциановый метод
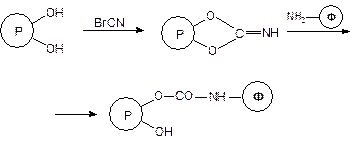
б) метод с использованием глутарового диальдегида
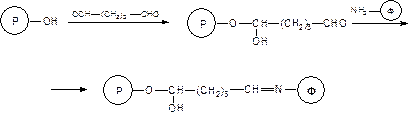
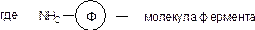
Следует отметить, что при использовании глутарового диальдегида очеь высока вероятность сшивки носителя за счет реакции привитых альдегидных групп с функциональными группами соседних цепей носителя. Однако, эта способность иногда используется для формирования сшитых систем, в которых роль сшивающего агента играет молекула иммобилизуемого фермента
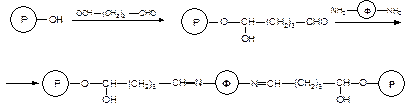
Кроме сефарозы для иммобилизации белков используют сефадекс тех марок, которые имеют низкий процент сшивающего агента. Получающиеся полимер-ферментные ковалентные комплексы могут быть использованы для проведения различных ферментативных реакций. Основным достоинством их использования по сравнению с проведением тех же реакций в растворе является то, что продукты реакции очень легко, простым фильтрованием, отделяются от фермента. Это обстоятельство определило широкое применение таких систем в промышленности.
Кроме носителей гелевого типа для иммобилизации ферментов используются и носители других типов — микрогетерогенные, а также высокопористые неорганические носители. Это связано с главным недостатком носителей гелевого типа — их очень низкой механической прчностью, а также (это относится к носителям на носнове полисахаридов) нестойкостью по отношению к действию микроорганизмов. Гетерогенные носители имеют свои недостатки. Наиболее существенным из них является взаимодействие молекул фермента с поверхностью носителя, что может привести к сильным изменениям нативной конформации и, как следствие, к потере значительной части активности.
Вообще проблема сохранения активности при присоединении молекул белков к носителям является ключевой. Часто бывает неизвестно, какие функциональные группы входят в связывающий и активный центры фермента. Если эти группы либо участвуют в образовании ковалентной связи между носителем и белком, либо оказываются стерически блокированными в результате присоединения к носителю, происходит частичная или полная потеря ферментативной активности. Для того, чтобы активность полимер-ферментного комплекса сохранялась на уровне, близком к активности того же фермента в растворе, используют различные приемы.
Большое значение имеет исследование зависимости активности полимер-ферментного комплекса от условий присоединеия — значений рН, природы буферного раствора, химической природы образующейся ковалентной связи. В очень большой степени эти исследования имеют эмпирический характер, а положительные их результаты, как правило, являются секретом фирмы.
Одним из приемов, позволяющих избежать значительной потери активности за счет стерического блокирования активного центра при присоединении белковых молекул непосредственно к цепям или поверхности полимерного носителя, является использование так называемого спейсера — промежуточной цепочки, позволяющей удалить молекулу фермента от цепи или от поверхности носителя
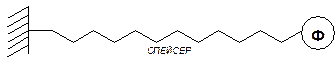
Это не только снижает стерические сложности, но и увеличивает подвижность (как число степеней свободы) иммобилизованных молекул самого фермента. Естественно, что длина и природа спейсера оказывают существенное влияние на акивность полимер-ферментного комплекса.
Еще одним оригинальным приемом, позволяющим ковалентно присоединить фермент к носителю по функциональным группам, не входящим ни в активный, ни в связывающий центры, является иммобилизация фермент-ингибиторного комплекса. Ингибиторы — это вещества, структурно схожие с субстратами и поэтому способные образовывать комплекс с ферментом. Отличием их от субстратов явлется неспособность подвергаться химическим превращениям под действием ферментов.Таким образом, ингибитор, блокируя связывающий и активный центры молекул фермента, существенно повышает вероятность их присоединения к носителю за счет функциональных групп, не входящих в эти центры
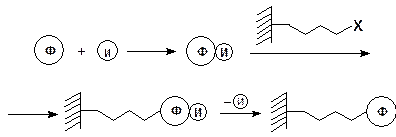
Молекулы самого ингибитора также могут быть ковалентно присоединены к полимерному носителю. Получающиеся комплексы служат эффективными аффинными сорбентами для выделения определенного фермента из смеси белков.
В заключение настоящего раздела следует кратко рассмотреть вопрос об иммобилизации более крупных объектов — живых клеток. Очень многие процессы, особенно в пищевой, микробиологической промышленности реализуются с участием различных культур микроорганизмов. Часто отделение микроорганизмов от продуктов реакции представляет собой сложную технологическую задачу. Иммобилизация живых клеток позволяет существенно ее упростить. Кроме того, иммобилизация живых клеток имеет ряд преимуществ перед иммобилизацией ферментов, и главным является то, что в клетке ферменты функционируют в нативном окружении, а значит, более эффективно.
Существуют разные методы иммобилизации клеток — сорбция на неорганических носителях, ковалентное присоединение, включение в полиакриламидный гель. Последний способ получил наибольшее распространение, что связано с относительной простотой метода и инертностью большинства клеток по отношению к гелю. Суть этого способа иммобилизации очень проста — культура микроорганизмов помещается в слабо сшитый полиакриламидный гель, при этом клетки свободно проникают между полимерными цепями. Затем производится дополнительное сшивание геля, плотность сетки возрастает и микроорганизмы теряют возможность в ней перемещаться, оказываются в ней заключенными, не теряя при этом своей функциональной активности.
Работы по иммобилизации ферментов и живых клеток на полимерных носителях приобретают все более возрастающее значение в той новой области науки и производства, которая называется биотехнология.
Дата добавления: 2015-06-22; просмотров: 1344;
