Электролиз
Бериллий не может быть получен электролизом водных растворов его солей, так как имеет высокий отрицательный электродный потенциал, поэтому при электролизе на катоде выделяется водород. Электролитическое производство можно осуществить, используя расплавы солей, в частности расплавы галогенидов бериллия. Однако их расплавы не проводят тока, поэтому электролиз возможен лишь в присутствии второго композита, обладающего достаточной электропроводностью и более высоким по сравнению с галогенидами бериллия напряжением разложения. Этими свойствами обладают галогениды щелочных металлов.
Соответствующий состав электролита в принципе допускает использование и хлоридной, и фторидной ванн. Но высокая температура плавления BeF2 (800°С) обусловливает проведение высокотемпературного процесса. Это влечет за собой конструктивные затруднения и способствует окислению выделяющегося металла. Предпочитают низкотемпературный электролиз из ванны, содержащей хлориды бериллия и натрия. Оптимальный состав электролита был найден в результате изучения плавкости в системе BeCl2–NaCl (рисунок 3.9). В системе обнаружена низкотемпературная эвтектика (215 °С), содержащая 50 % (мол.) BeCl и инконгруэнто плавящееся соединение Na2BeCl4. В этом соединении бериллий координационно связан с хлором, но связь неустойчива.
Электролиз проводят в сварных никелевых ваннах, снабженных электрическим нагревателем (рисунок 3.10). Анод изготовляют из плотного графита что снижает выкрашивание анода с поверхности и тем самым уменьшает возможность загрязнения электролита. Катодом служит сама никелевая ванна. В этом случае по окончании электролиза электролит перекачивают в другую ванну, а металл вычерпывают перфорированным ковшом. На некоторых предприятиях применяют съемные катоды в виде перфорированных никелевых ящиков, вставляемых в ванны. Ванну и катод перед электролизом бериллируют для уменьшения загрязнения никелем.
При загрузке BeCl2 и NaCl берут в массовом соотношении 1:1, что позволяет получить в электролите в начале электролиза 54 % (мол.) BeCl2. Загруженную смесь расплавляют в атмосфере хлора при 350°С. Большая электроположительность многих примесей (Сu, Fe, Pb, Ni) по сравнению с бериллием дает возможность освобождаться от них электролитическим путем. Предварительно, чтобы очистить электролит, электролиз проводят при пониженной плотности тока (280 А/м2) с цилиндрическим никелевым катодом, на котором выделяются примеси. После окончания очистки катод сменяют перфорированным и далее электролиз ведут при катодной плотности 600–700 А/м2.
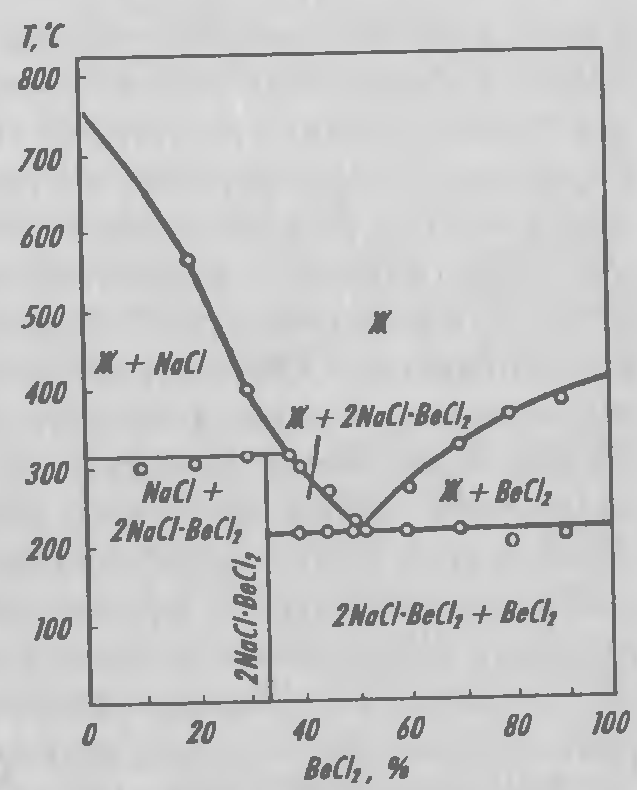
'Рисунок 3.9 — Диаграмма плавкости в системе BeCl2–NaCl.

Обозначено: а– ванна с сифоном для электролита; б– ванна со сменным катодом. 1– отсос; 2– анод; 3– сифон; 4– катод; 5– никелевая ванна; 6– обмотка нагревателя.
Рисунок 3.10 — Электролизер для получения металлического бериллия.
. Электролиз продолжают, пока содержание BeCl2 в ванне не снизится до 45 %. На это требуется около суток. Затем катод вынимают и заменяют новым. Перед сменой катода температуру ванны повышают до 380°С для увеличения текучести электролита. Состав ванны корректируют, добавляя BeCl2 до исходной концентрации его 54 % (мол.). Выход по току 50 %. Осажденный в виде дендритов бериллий промывают водой, затем раствором NaOH, разбавленной HNO3 и спиртом. В крупных кристаллах содержание бериллия 99,966, в мелких 99,937 %. Полученный электролизом бериллий можно подвергнуть переплавке в вакууме или направить непосредственно на металлокерамический передел.
Электролитический бериллий чище металлотермического (таблица 3.5). Это объясняется тем, что и электролиз, и предшествующее ему хлорирование ВеО — рафинирующие операции. Указанное преимущество делает электролитический метод конкурентоспособным, несмотря на значительно меньший выход металла.
Таблица 3.5 — Содержание примесей в металлическом бериллии в зависимости от способа получения.

Для удаления шлака и магния из магнийтермического бериллия, а также включений электролита из катодного продукта металл подвергают вакуумной плавке в индукционных печах в тиглях из ВеО при 133–267 Па и 1500–1550°С. При этом свободный магний, фторид бериллия и электролит испаряются, а нелетучие примеси ВеО, MgF2, Ве2С в виде шлака всплывают на поверхность либо оседают на дно тигля. Очищенный металл выливают в изложницу, в которой он кристаллизуется в слиток массой 75–100 кг. Иногда вакуумную плавку сочетают с центробежным литьем, что способствует удалению шлака и газов из отливок. Металл, полученный вакуумной плавкой, содержит 99,5% Be. Выход бериллия из корольков в отливку 90%.
Наиболее чистый бериллий получают вакуумной дистилляцией технического металла в интервале 1300–1400°С при остаточном давлении порядка 1,3·10-4 Па. Бериллий конденсируется на молибденовом экране, расположенном внутри трубки из оксида бериллия, обогреваемой электрическим током, который пропускают через молибденовую обмотку. Примеси конденсируются в различных температурных зонах, а наиболее чистый бериллий — в зоне с температурным интервалом 1120–1150°С. В верхней части экрана, в температурном интервале 900–1000°С конденсируется основная масса примесей алюминия в магния. Дистилляция в вакууме позволяет получать бериллий высокой чистоты.
В настоящее время основным методом получения качественных бериллиевых изделий является метод порошковой металлургии. Удобств метода применительно к бериллию определяется его хрупкостью, способствующей получению порошка, и достаточным давлением пара вблизи температуры плавления, что облегчает спекание.
Металлокерамическое производство бериллия. Для получения бериллиевых изделий можно применять различные варианты порошковой металлургии:
– холодное прессование, спекание и тепловую об работку полученных заготовок под давлением;
– горячую обработку давлением непосредственно порошка, обычно помещаемого для этого' стальные сварные оболочки (контейнеры);
–горячее прессование в вакууме с применением небольших удельных давлений;
– горячее прессование на воздухе с применением больших удельных давлений;
– прессование в вакууме при умеренных температурах и относительно небольшом удельном давлении (так называемое теплое прессование).
Технологический процесс начинается со стадии измельчения бериллия. Электролитические чешуйки измельчают в шаровой мельнице мокрого помола. Затем порошок обрабатывают щавелевой кислотой для извлечения примесей хлора и хлоридов. Попытки приготовить порошки бериллия непосредственно из магниетермического металла оказались неудачными из-за выраженной интеркристаллитной коррозии в изделиях, поскольку в таких порошках имеется небольшое количество шлака. С целью получения доброкачественных слитков для изготовления бериллиевого порошка современная техника производства заготовок обязательно включает вакуумную переплавку чернового металла для удаления из него остатков шлака и магния. Для изготовления порошка переплавленный в вакууме слиток обтачивают на токарном станке, а полученную стружку измельчают в атмосфере сухого азота в дисковом истирателе, водоохлаждаемые диски которого футерованы бериллием.
Большую часть металлокерамических заготовок получают горячим прессованием в вакууме при 1000–1150°С и давлении 0,5–1,0 кПа, после чего они могут быть обработаны горячим выдавливанием, прокаткой или ковкой в стальных контейнерах.
Прочность и пластичность бериллиевых изделий, получаемых методом металлокерамики, регулируется главным образом величиной частиц исходного порошка. Одним из основных критериев качества готовых бериллиевых изделий является их плотность, которая составляет 1,83–1,845 г/см3 (теоретическая плотность бериллия, содержащего обычные примеси, 1,845–1,855 г/см3).
Литература по металлургии бериллия
1. Редкие и рассеянные элементы. Химия и технология. Книга I. М.: МИСИС, 1996. 376 с.
2. Редкие и рассеянные элементы. Химия и технология. Книга II. М.: МИСИС, 1999. 461 с.
3. Редкие и рассеянные элементы. Химия и технология. Книга III. М.: МИСИС, 2003. 440 с.
4. Химия и технология редких и рассеянных элементов. Часть I. М.: Высш. школа, 1976. 368 с.
5. Химия и технология редких и рассеянных элементов. Часть II. М.: Высш. школа, 1976. 360 с.
6. Химия и технология редких и рассеянных элементов. Часть III. М.: Высш. школа, 1976. 320 с.
Дата добавления: 2015-06-22; просмотров: 2448;
