Технология получения важнейших соединений бериллия
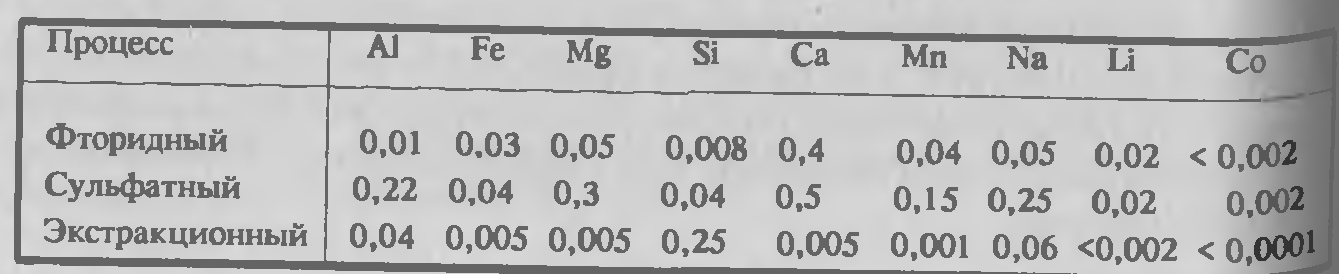
Состав гидроксида бериллия, который получается по сульфатному и фторидному методу, сопоставлен в таблице 3.3. Видно, что без дополнительных перечисток более чистый продукт получается по фторидной схеме. Технический оксид бериллия получают из гидроксида. Гидроксид высушивают на противнях в сушильных печах при 100–150°С, затем прокаливают при 850–1000°С во вращающихся печах с наружным газовым обогревом.
Для некоторых отраслей техники, в первую очередь для ядерной энергетики, требуется оксид бериллия высокой чистоты. Для его получения технический гидроксид подвергают перечистке, используя следующие способы:
Карбонатно-аммонийный способ очистки основан на растворении гидроксида бериллия в насыщенном растворе карбоната аммония, тогда как гидроксиды алюминия и железа нерастворимы в нем. Дополнительная очистка от следов тяжелых металлов достигается осаждением сульфидов. При кипячении раствора комплексный карбонат (NH4)2[Be(CО3)2] разлагается с выделением основного карбоната бериллия Ве(ОН)2СО3. Прокаливанием последнего получают оксид бериллия.
В некоторых схемах чистый оксид получают через кристаллогидрат сульфата бериллия BeSО4·4Н2О. Кристаллы сульфата бериллия очищают перекристаллизацией. При этом используется уменьшение растворимости последнего с понижением температуры (при 100°С она равна 45 %, а при 25 °С 29,9 %). Термическим разложением сульфата при 1100°С получают оксид бериллия.
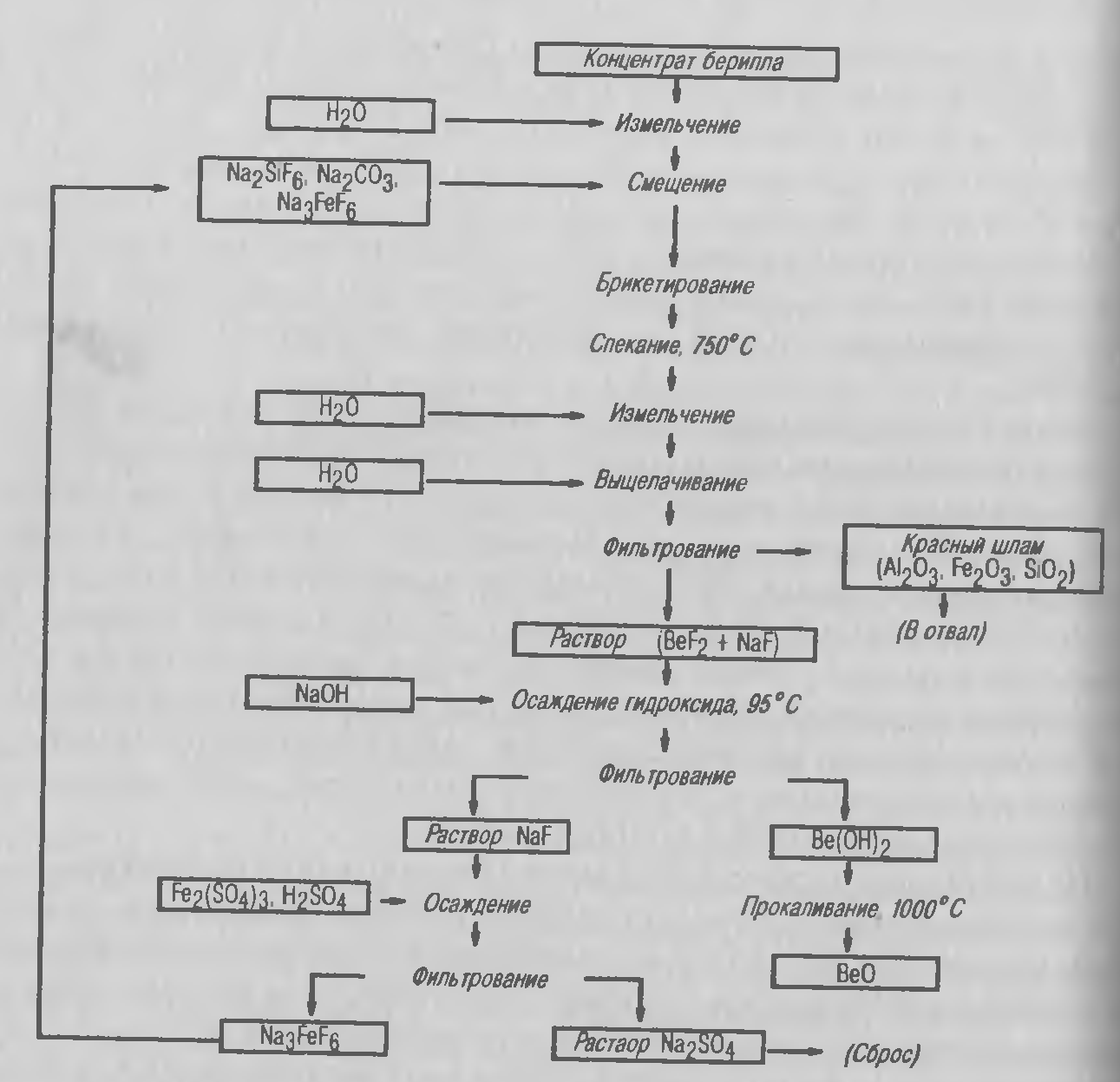
'Рисунок 3.8 — Принципиальная технологическая схема получения BeO фторидным способом.
Таблица 3.4 —Химический состав гидроксида бериллия полученный по различным схемам (% масс.).
Эффективен ацетатный способ очистки, который заключается в возгонке оксиацетата бериллия Ве4О(СН3СОО)6 при 360–400°С. Этот способ дает продукт, удовлетворяющий по чистоте (более 99 % ВеО) требованиям, предъявляемым к материалам для ядерной техники. Оксид бериллия получается в тонкодисперсной форме, что имеет исключительно важное значение в производстве изделий из него, так как способствует увеличению их плотности.
Фторид бериллия — исходный материал для производства металлического бериллия. Его получают термическим разложением тетрафторобериллата аммония (NH4)2BeF4. Гидроксид бериллия растворяют в растворе гидродифторида аммония так, чтобы в растворе содержалось 20 г/л Be при рН 5,5. Затем в этот раствор добавляют твердый карбонат кальция и смесь нагревают до 80°С; при рН 8,3 происходит полное выделение из раствора примесей железа и алюминия без осаждения Be(ОН)2. При добавлении в образовавшуюся пульпу диоксида свинца окисляются и затем осаждаются марганец и хром в виде МnО2 и РbСrO4. Медь, никель и свинец можно осадить из отфильтрованного раствора с помощью полисульфида аммония (NH4)2S8.
Из раствора со стехиометрическим соотношением NH4F : BeF2 = 2 : 1 в процессе вакуумной выпарки кристаллизуется тетрафторобериллат. Кристаллы (NH4)2BeF4 разлагают при 900–1100 °С (выше точки плавления BeF2) в графитовых тиглях, помещенных в индукционную печь. В результате получают стекловидный фторид бериллия. Газообразный фторид аммония улавливают в скруббере и электрофильтре. Растворы, содержащие фторид аммония, используют для растворения гидроксида бериллия.
Хлорид бериллия — получают хлорированием оксида бериллия хлором в присутствии углерода или взаимодействием ВеО с тетрахлоридом углерода. Хлорированию подвергают брикетированную шихту ВеО + С (при хлорировании хлором) или брикеты ВеО (при хлорировании ССl4) в хлораторах шахтного типа. Образующийся при хлорировании газообразный хлорид бериллия улавливают в конденсационной системе. Поддерживая различную температуру в последовательно установленных конденсаторах, можно осуществить фракционную конденсацию ВеСl2 и летучих хлоридов примесей в соответствии с их температурами кипения. Однако отделение примесей при этом неполное. Поэтому хлорид бериллия очищают повторной дистилляцией при 500–550 °С в атмосфере водорода. Последний восстанавливает FeСl3 до нелетучего FeСl2. Прямой выход при хлорировании ССl4 составляет 85,7 %, с учетом переработки отходов 96%.
Дата добавления: 2015-06-22; просмотров: 3059;
