Степені вільності молекул. Розподіл енергії по степеням вільності. Внутрішня енергія ідеального газу
Числом степеней вільності називається мінімальна кількість незалежних величин, якими можна однозначно задати положення системи у просторі.
 Для матеріальної точки (молекула одноатомного газу) у просторі достатньо задати три координати x, y, z. Ці координатні степені вільності називаються поступальними. Для двохатомної жорсткої молекули можна задати 6 координат її атомів. Але вимога мінімальності приводить до того, що положення такої молекули задають трьома координатами одного із атомів і два кути (рис.6.21): меридіальний θ і азимутальний φ. Ці кутові степені вільності називаються обертальними. Всього одержали
Для матеріальної точки (молекула одноатомного газу) у просторі достатньо задати три координати x, y, z. Ці координатні степені вільності називаються поступальними. Для двохатомної жорсткої молекули можна задати 6 координат її атомів. Але вимога мінімальності приводить до того, що положення такої молекули задають трьома координатами одного із атомів і два кути (рис.6.21): меридіальний θ і азимутальний φ. Ці кутові степені вільності називаються обертальними. Всього одержали
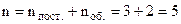 , а не 6 поступальних. Для двохатомної нежорсткої молекули, тобто коли відстань між атомами може змінюватись, що має місце при досить високих температурах, тобто атоми коливаються, потрібно задати ще одну степінь вільності. Ця степінь вільності називається коливальною. Одержуємо
, а не 6 поступальних. Для двохатомної нежорсткої молекули, тобто коли відстань між атомами може змінюватись, що має місце при досить високих температурах, тобто атоми коливаються, потрібно задати ще одну степінь вільності. Ця степінь вільності називається коливальною. Одержуємо 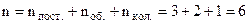 .
.
 Для трьохатомної жорсткої молекули необхідно задати, як і для двохатомної жорсткої молекули, три координати одного атома і три кути (рис.6.22). Третій кут γ задає орієнтацію площини молекули. Одержуємо
Для трьохатомної жорсткої молекули необхідно задати, як і для двохатомної жорсткої молекули, три координати одного атома і три кути (рис.6.22). Третій кут γ задає орієнтацію площини молекули. Одержуємо

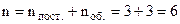 . У випадку нежорсткої трьохатомної молекули необхідно задати ще 3 відстані між атомами – 3 коливальні степені вільності. Всього буде 9. Із збільшенням кількості атомів буде зростати кількість коливальних степенів вільності, а поступальних і обертальних буде по 3. Таким чином, система із N частинок має
. У випадку нежорсткої трьохатомної молекули необхідно задати ще 3 відстані між атомами – 3 коливальні степені вільності. Всього буде 9. Із збільшенням кількості атомів буде зростати кількість коливальних степенів вільності, а поступальних і обертальних буде по 3. Таким чином, система із N частинок має
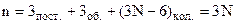 степеней вільності.
степеней вільності.
Теплова енергія по степеням вільності розподіляється рівномірно, тобто на кожну поступальну і обертальну степінь припадає енергія 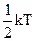 , а на коливальну
, а на коливальну 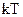 (
( 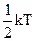 на кінетичну енергію коливань атомів в молекулі,
на кінетичну енергію коливань атомів в молекулі, 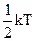 на потенціальну енергію їх взаємодії). Кількість половинок kT теплової енергії молекули позначимо буквою і. Тоді
на потенціальну енергію їх взаємодії). Кількість половинок kT теплової енергії молекули позначимо буквою і. Тоді
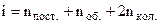 . (6.39)
. (6.39)
Досить часто мають справу з невисокими температурами, коли коливальні степені ще не збуджуються. Тоді число і дорівнює числу n кількості степеней вільності. Тому досить часто число і називають кількістю степеней вільності.
Середня теплова енергія молекули, яку розглядають не як матеріальну точку, включає не тільки поступальну енергію, а і обертальну та коливальну. Тому 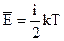 . (6.40)
. (6.40)
Внутрішня енергія ідеального газу складається тільки із теплової енергії молекул, потенціальна енергія дорівнює нулю, так як молекули не взаємодії між собою.
Отже, 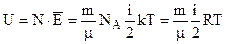 , (6.41)
, (6.41)
де: NA – число Авогадро, m – маса газу, μ – молярна маса, k – стала Больцмана, R – газова стала, Т – абсолютна температура.
Вираз (6.41) показує, що внутрішня енергія даної кількості газу залежить тільки від температури.
Дата добавления: 2015-06-17; просмотров: 3201;
