Перше начало термодинаміки
Внутрішня енергія – це сума кінетичної енергії атомів і молекул, потенціальної енергії їх взаємодії, атомна, ядерна енергія і т.д. за винятком кінетичної і потенціальної енергії системи як цілого. Внутрішня енергія є функцією стану системи. Це означає, що певному стану системи відповідає єдине значення внутрішньої енергії незалежно від того, як вона потрапила в цей стан. Внутрішню енергію можна змінити трьома процесами:
а) за рахунок виконання системою чи над нею роботи. Наприклад, при стискуванні газу в циліндрі від рухомого поршня молекули будуть відбиватись з швидкістю більшою на подвоєну швидкість поршня, ніж падають (див. розділ 4.8). А це означає збільшення кінетичної енергії хаотичного руху молекул, тобто внутрішньої енергії газу, при виконанні над ним роботи по його стисканню. Аналогічно при розширенні газу, тобто при виконанні ним роботи, молекули будуть відбиватись від поршні з меншою швидкістю, ніж падати. Отже, якщо система виконує роботу, її внутрішня енергія зменшується. Якщо над системою виконується робота, її внутрішня енергія зростає;
б) за рахунок теплообміну, тобто передачі або відбиранні теплової енергії без виконання механічної роботи. Цю енергію називають теплотою. Якщо тепло передається системі, її внутрішня енергія зростає, якщо ж забирається – зменшується;
в) за рахунок зміни кількості частинок системи. Цей процес поки що розглядати не будемо, тобто будемо вивчати системи незмінної кількості частинок.
Таким чином механічна робота і теплота являються мірою зміни внутрішньої енергії. Тому ці три фізичні величини мають однакову розмірність – джоуль (Дж). Одиницею теплоти являється позасистемна одиниця – калорія. Це кількість теплоти, необхідна для нагрівання 1 г води від 19,5оС до 20,5оС. Еквівалентність теплоти і роботи експериментально встановив Джоуль по нагріванню ртуті при її перемішуванні лопатками, які приводились в рух падаючою гирею. Він встановив механічний еквівалент теплоти 1 кал = 4,19 Дж.
Таким чином із врахуванням знаків роботи, кількості теплоти і  зміни внутрішньої енергії (рис.6.20), можна сформулювати закон збереження енергії (перше начало термодинаміки):
зміни внутрішньої енергії (рис.6.20), можна сформулювати закон збереження енергії (перше начало термодинаміки):
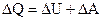 (6.38)
(6.38)
 Тепло ∆Q, передане системі, іде на зміну ∆U її внутрішньої енергії і на виконання системою роботи ∆A.
Тепло ∆Q, передане системі, іде на зміну ∆U її внутрішньої енергії і на виконання системою роботи ∆A.
Дата добавления: 2015-06-17; просмотров: 946;
