Молекулярно-кінетична теорія теплоємності газів
Питомою теплоємністю називається кількість теплоти, яка необхідна для нагрівання на 1 градус 1 кг речовини
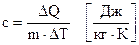 . (6.47)
. (6.47)
Молярною теплоємністю називається кількість теплоти, яка необхідна для нагрівання на 1 градус 1 моля речовини
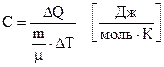 . (6.48)
. (6.48)
Ці теплоємності зв’язані між собою співвідношенням 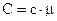 .
.
Розглянемо два режими нагрівання газу: ізохорний і ізобарний.
Ізохорний. Враховуючи (6.38), (6.41) і (6.44) кількість теплоти, необхідна для нагрівання 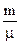 молей газу на ∆Т
молей газу на ∆Т 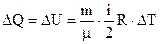 . Підставляємо в (6.48). Одержуємо
. Підставляємо в (6.48). Одержуємо
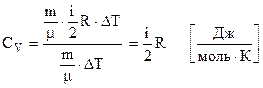 . (6.49)
. (6.49)
Ізобарний. Враховуючи (6.38), (6.41) і (6.45) кількість теплоти, необхідна для нагрівання 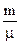 молей газу на ∆Т
молей газу на ∆Т
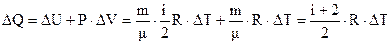
. Підставляємо в (6.48). Одержуємо
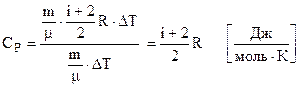 . (6.50)
. (6.50)
Бачимо, що 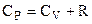 . (6.51)
. (6.51)
Це співвідношення Майєра. Теплоємність Ср > CV тому, що при ізобарному процесі підведене тепло іде не тільки на зміну внутрішньої енергії (як при ізохорному процесі), а і на виконання роботи. Ясно, що в цьому випадку потрібно підвести більше теплоти.
Характерним для кожного газу є відношення теплоємностей

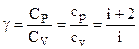 . (6.52)
. (6.52)


 Одержані вирази для теплоємностей газу показують, що вони не залежать від температури. Але експеримент дає ступінчату залежність (рис.6.25) для газів багатоатомних молекул. Таку залежність неможливо пояснити в рамках класичної фізики. Вона пояснюється в рамках квантових уявлень, а саме дискретним характером зміни фізичних величин, в нашому випадку обертальної та коливальної енергії молекул. При низьких температурах теплової енергії не вистачає для збудження обертального руху молекул і коливального руху атомів в них. Тобто, обертальні і коливальні степені вільності не збуджуються. Вони послідовно починають збуджуватись при підвищенні температури. Наприклад, двохатомні молекули при зіткненні, як показано на рис.6.26, не приходять в обертальний рух. В той час як по класичним уявлення при такому зіткненні молекули повинні прийти в обертання. Отже, залежність (рис.6.25) зумовлена ступінчатою зміною кількості степеней вільності (числа і).
Одержані вирази для теплоємностей газу показують, що вони не залежать від температури. Але експеримент дає ступінчату залежність (рис.6.25) для газів багатоатомних молекул. Таку залежність неможливо пояснити в рамках класичної фізики. Вона пояснюється в рамках квантових уявлень, а саме дискретним характером зміни фізичних величин, в нашому випадку обертальної та коливальної енергії молекул. При низьких температурах теплової енергії не вистачає для збудження обертального руху молекул і коливального руху атомів в них. Тобто, обертальні і коливальні степені вільності не збуджуються. Вони послідовно починають збуджуватись при підвищенні температури. Наприклад, двохатомні молекули при зіткненні, як показано на рис.6.26, не приходять в обертальний рух. В той час як по класичним уявлення при такому зіткненні молекули повинні прийти в обертання. Отже, залежність (рис.6.25) зумовлена ступінчатою зміною кількості степеней вільності (числа і).
Дата добавления: 2015-06-17; просмотров: 1554;
