Хлорная кислота
Хлорная кислота HClO4 является типичным представителем сильным минеральных кислородсодержащих кислот (неорганических) наряду с HNO3, H2SO4 и H3PO4, однако, до сих пор считается достаточно экзотическим веществом.
HClO4 – бесцветная жидкость с резким запахом. tпл = –102°C, плотность близка к плотности H2SO4 d20 = 1,77 г/см3. Температура кипения трудно определима, так как при кипении кислота разлагается.
В 100% HClO4 имеет место равновесие
3HClO4  Cl2O7 + HClO4•H2O
Cl2O7 + HClO4•H2O
Структура хлорной кислоты – искажённый тетраэдр с вытянутой одной связью Cl–O. В жидком состоянии молекулы кислоты ассоциированы за счёт водородных связей, но эта связь наименее прочная из всех минеральных кислот.
Ангидрид хлорной кислоты – Cl2O7, единственный высший оксид среди галогенов, может быть получен при окислении хлора озоном:
Cl2 + O3 = ClO + ClO2
ClO2 + O3 = ClO3 + O2
2ClO3 = ClO4 + ClO2
ClO4 + ClO3 = Cl2O7
либо действием водоотнимающих агентов на хлорную кислоту:
2HClO4 + P2O5 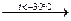 2HPO3 + Cl2O7
2HPO3 + Cl2O7
Cl2O7 – бесцветная, легко летучая жидкость с сильным удушающим запахом, tпл = –90°C. Разлагается на элементы при 100°C:
Cl2O7 = Cl2 + 3,5O2
Медленно реагирует с водой с образованием хлорной кислоты и выделением большого количества тепла.
Структура:
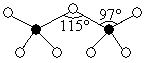
Хлорная кислота образует 6 гидратов от HClO4•0,75до HClO4•42O. Из них моногидрат проявляет особые аномальные свойства. Его tпл = 50°C на 100-130°C выше температуры плавления остальных гидратов. Это объясняется тем, что это – ионное соединение – перхлорат оксония H3O+ClO4-.
С химической точки зрения хлорная кислота проявляет и окислительные, и кислые свойства. Является сильным окислителем, причём продукты восстановления – низкие окислы хлора, являются ещё более сильными окислителями, чем сама кислота. Ox-Red реакции с участием HClO4 проходят до конца и необратимы:
2HClO4 + S = H2SO4 + Cl2 + O2
Обменные реакции с участием HClO4 идут с трудом.
Термическое разложение HClO4 начинается при комнатной температуре и заметно ускоряется при повышении температуры до 100°C. При 100°C, если не произошло взрыва, начинает перегонка. Среди продуктов разложения можно обнаружить все окислы хлора, Cl2, HCl и кислород, а также обязательно моногидрат. Брутто-реакция:
6HClO4 = 2HClO4•H2O + 4ClO2 + 3O2
Дата добавления: 2015-06-17; просмотров: 2356;
