Получение HCl
Хлороводород в промышленности получают либо прямым синтезом из хлора и водорода, либо из побочных продуктов при хлорировании алканов (метана). Мы будем рассматривать прямой синтез из элементов.
HCl – бесцветный газ с резким, характерным запахом
t°пл= –114,8°C, t°кип= –84°C, t°крист= +57°C, т.е. хлороводород можно получать при комнатной температуре в жидком виде, увеличивая давление до 50 – 60 атм. В газовой и жидкой фазе находится в виде отдельных молекул (отсутствие водородных связей). Прочное соединение Есв= 420 кДж/моль. Начинает разлагаться на элементы при t>1500°C.
2HCl  Cl2 + H2
Cl2 + H2
Эффективный радиус HCl = 1,28 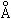 , диполь – 1,22
, диполь – 1,22 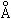 .
.
RCl- = 1,81 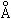 , т.е. протон внедряется в электронное облако иона хлора на треть эффективного радиуса и при этом происходит упрочнение самого соединения, вследствие повышения положительного заряда вблизи ядра иона хлора и уравновешивания отталкивающего действия электронов. Все галогеноводороды образованы аналогично и являются прочными соединениями.
, т.е. протон внедряется в электронное облако иона хлора на треть эффективного радиуса и при этом происходит упрочнение самого соединения, вследствие повышения положительного заряда вблизи ядра иона хлора и уравновешивания отталкивающего действия электронов. Все галогеноводороды образованы аналогично и являются прочными соединениями.
Хлороводород хорошо растворим в воде в любых соотношениях (в одном объеме H2O расторяется до 450 объемов HCl), с водой образует несколько гидратов и дает азеотропную смесь – 20,2% HCl и t°кип= 108,6°C.
Образование хлороводорода из элементов:
Cl2 + H2 = 2HCl
Смесь водорода и хлора при освещении взрывается, что указывает на цепной характер реакции.
В начале века Баденштейн предложил следующий механизм реакции:
Инициирование: Cl2 + hν → ē + Cl2+
Цепь: Cl2+ + H2 → HCl + H• + Cl+
H• + Cl2 → HCl + Cl•
……..
Обрыв цепи: Cl+ + ē → Cl
Cl + Cl → Cl2
Но ē в сосуде обнаружен не был.
В 1918 г. Нернст предложил другой механизм:
Инициирование: Cl2 + hν → Cl• + Cl•
Цепь: Cl• + H2 → HCl + H•
H• + Cl2 → HCl + Cl•
………
Обрыв цепи: H• + Cl• → HCl
В дальнейшем этот механизм получил дальнейшее развитие и дополнение.
1 стадия – инициирование
реакция Cl2 + hν → Cl• + Cl•
Инициируется фотохимическим путем, т.е. путем поглощения кванта света hν. Согласно принципу эквивалентности Эйнштейна каждый квант света может вызвать превращение только одной молекулы. Количественной характеристикой принципа эквивалентности является квантовый выход реакции:

– количество прореагировавших молекул приходящихся на 1 квант света.
γ в обычных фотохимических реакциях ≤1. Однако в случае цепных реакций γ>>1. Например, в случае синтеза HCl γ=105, при распаде H2O2 γ=4.
Если молекула Cl2 поглотила квант света, то она находится в возбужденном состоянии
10-8-10-3сек и, если полученной с квантом света энергии хватило для превращения, то происходит реакция, если нет, то молекула снова перейдет в основное состояние, либо с испусканием кванта света (флуоресценция или фосфоресценция), либо электронное возбуждение конверсируется в энергию колебания или вращения.
Посмотрим, что происходит в нашем случае:
Едис Н2 = 426,4 кДж/моль
ЕдисCl2 = 239,67 кДж/моль
ЕобрHCl = 432,82 кДж/моль – без облучения реакция не идет.
Квант света имеет энергию Екв = 41,1*10-20 Дж. Энергия, необходимая для начала реакции (энергия активации) ровна энергии, затраченной диссоциацию молекулы Cl2:

т.е. ЕCl2<Екв и энергии кванта достаточно для преодоления потенциального барьера реакции и реакция начинается.
В отличие от катализа, при котором потенциальный барьер снижается, в случае фотохимических реакций он просто преодолевается за счет энергии кванта света.
Еще одна возможность инициирования реакции – добавление паров Na в смесь H2+Cl2. Реакция идет при 100°C в темноте:
Na + Cl2 → NaCl + Cl•
Cl• + H2 → HCl + H• ………
и образуется до 1000 HCl на 1 атом Na.
2 стадия – продолжение цепи
Реакции продолжения цепи при получении HCl бывают следующих типов:
1. Cl• + H2 → HCl + H• Ea=2,0 кДж/моль
2. H• + Cl2 → HCl + Cl• Ea=0,8 кДж/моль
Это звенья цепи.
Скорость данных реакций можно представить следующим образом:
W1 = K1[Cl•][ H2]
W2 = K2[H•][ Cl2]
Т.к. энергии активации этих реакций малы, то их скорости велики. Цепи в данном случае неразветвленные, а по теории неразветвленных цепей:
Wразвитие цепи = Wициируется фотохимическим путем, т.е. путем поглощения кванта светаобрыва,
тогда, если считать, что обрыв квадратичен:
Cl• + Cl• +М → Cl2 + М,
то Wобр = К[Cl•]2
 От реакций 1 и 2 зависит скорость получения HCl
От реакций 1 и 2 зависит скорость получения HCl
в данном случае W1 =W2, т.к.цепи достаточно длинные (из теории цепных реакций)

Данное кинетическое уравнение справедливо в отсутствие примесей в смеси H2 + Cl2. Если в систему попадет воздух, то кинетическое уравнение будет иное. В частности
Wобр = K[Cl•], т.е. не квадратичный обрыв и ход процесса полностью меняется.
Т.к. есть вещества, являющиеся ингибиторами цепных реакций. Ингибитором реакции образования HCl является кислород:
O2 + H• → O2H•
Этот радикал малоактивен и может реагировать только с таким же радикалом, регенерируя кислород
O2H• + O2H• = O2 + H2O2
Расчеты показывают, что в присутствии 1% O2 реакция замедляется в 1000 раз. Еще более сильно замедляет скорость процесса присутствие NCl3, который замедляет реакцию в 105 раз сильнее, чем кислород. Т.к. хлорид азота может присутствовать в хлоре в процессе его получения в промышленности, необходима тщательная очистка исходного хлора перед синтезом HCl.
Механизм действия NCl3:
NCl3 + Cl• → NCl2• + Cl2
малоакт. радикал
и восстановление Cl• идет чрезвычайно медленно и идет процесс
2NCl2• → 2Cl2 + N2
3 стадия – обрыв цепи
Представление Нернста о механизме обрыва цепи при тщательном исследовании не подтвердилось.
В данном случае возможно 3 способа рекомбинации радикалов:
1. Cl• + Cl• +М → Cl2 + М
2. H• + H• + М → H2 + М
3. H• + Cl• + М → HCl + М
 Используя реакции развития цепи 1 и 2 и то, что при длинных цепях W1 =W2 можно показать, что
Используя реакции развития цепи 1 и 2 и то, что при длинных цепях W1 =W2 можно показать, что
! - стерический фактор

Отсюда , что при t ~ 600°C и [Cl2] ≈ [H2] (условия синтеза HCl), дает
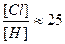
Следовательно, скорость рекомбинации по 1 будет в 25 раз выше, чем по 3 и в 625 раз, чем по 2, т.е. процессами 2 и 3 можно практически пренебречь.
Дата добавления: 2015-06-17; просмотров: 5476;
