Взаимодействие SO2 с нитрозой.
По третьей стадии протекают следующие процессы:
1). Поглощение SO2
SO2 + H2O  H2SO3
H2SO3
2). Гидролиз нитрозилсерной кислоты
2HNOSO4 + H2O  2H2SO4 + N2O3
2H2SO4 + N2O3
3). Окисление сернистой кислоты
H2SO3 + N2O3  H2SO4 + NO
H2SO4 + NO
4). Десорбция NO и его окисление
2NO + O2 → 2NO2
5). Окисление SO2 в газовой фазе и поглощение SO3 водой
SO2 + N2O3 → SO3 + 2NO
SO3 + H2O = H2SO4
В основной продукционной башне протекают следующие процессы.
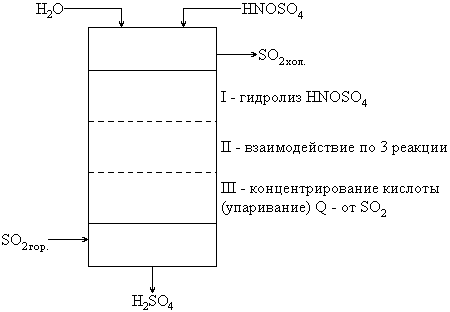
При низкой температуре лимитирующая стадия – I – гидролиз HNOSO4 – кинетическая. При высокой – образование H2SO3 – диффузионная. Поэтмоу процесс ведут при 100-110°C.
Схема башенного способа
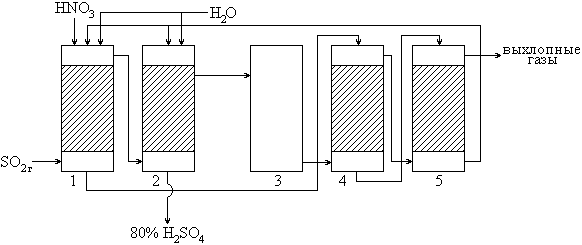
Газ, содержащий SO2, очищается от пыли и поступает в продукционные башни (1 и 2), где встречается со стекающей нитрозой и окисляется. Часть полученной кислоты отделяется в основной башне (2), часть идёт на образование нитрозы в поглотительные башни (4 и 5). Очищающийся в отходящих газах NO окисляется в окислительной башне (3) и также поступает на образование нитрозы в башни 4 и 5. Образующаяся нитроза поступает на орошение продукционных башен. Вследствие потерь окислов азота они ещё подпитываются HNO3.
Нитрозным способом производится грязная 70-80% H2SO4, которая, в основном, используется для получения удобрений.
Контактный способ производства H2SO4.
Способ наиболее прогрессивный. По этому способу производится большое количество сортов H2SO4 (олеум, купоросное масло (53% и т.д.), аккумуляторная кислота).
Контактный способ включает 3 стадии:
1) очистку газа от вредных для катализа примесей
2) контактное окисление диоксида серы в триоксид
3) абсорбцию SO3 серной кислотой.
Главная стадия №2.
2) Контактное окисление – типичный гетерогенный катализ.
Реакция обратимая.
SO2 + 1/2O2  SO3 + Q
SO3 + Q
При повышении температуры реакция быстро падает. С ростом температуры падает и степень превращения. Константа скорости реакции растёт с ростом температуры.
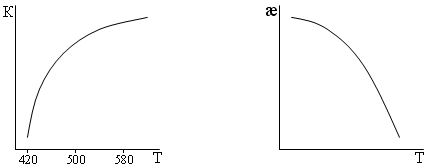
æ= РSO3/(PSO2 + PO2)
Наиболее активным катализатором является Pt, но она дорога и быстро отравляется. В настоящее время применяется катализатор БАВ: K2O•SiO2•BaO•Al2O3•V2O5 (V2O5 – основа ~7%), катализатор СВД – сульфат ванадила на доломите.
Процесс катализа слагается из стадий:
1) диффузия компонентов к гранулам катализатора, а затем в поры
2) сорбция кислорода
3) сорбция SO2 и образование комплекса SO2•О
4) перегруппировка электронов с образованием комплекса SO3•катализатор
5) десорбция SO3 из пор и с поверхности катализатора
Т.к. реакция экзотермическая, а при повышении температуры падает æ (а значит и выход SO3) процесс ведут следующим образом:
Сначала проводят окисление при высокой температуре 500-5500С, реакция протекает быстро со степенью окисления около 50%. Далее понижают температуру и пропускают газ снова через катализатор, затем его снова охлаждают и так несколько раз (4-5) до достижения степени превращения SO3 ~ 95%.
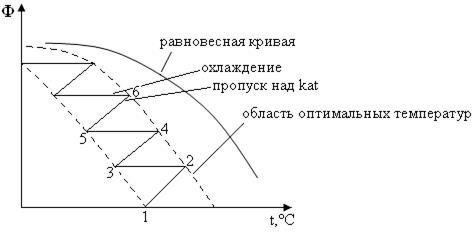
В настоящее время используют в основном полочные контактные аппараты, в которых отвод тепла проводится в теплообменниках между полками. Аппарат высотой до 30 м и диаметром 15 м.
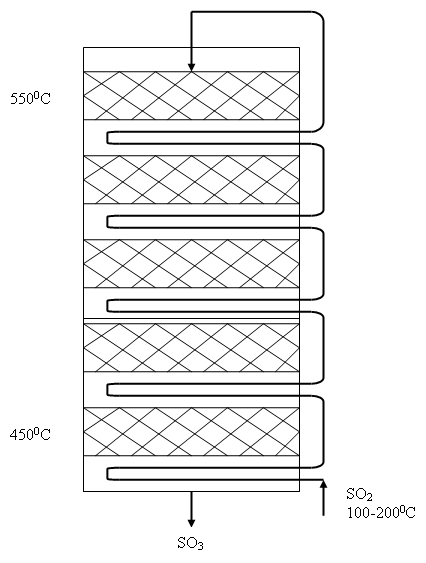
Для предотвращения отравления катализатора необходима тщательная очистка газов от примесей As, Se, Te и других.
3). Абсорбцию триоксида серы проводят обычно в башнях с насадкой.
При этом поглощение ведут не водой (в этом случае образуется трудноуловимый туман серной кислоты), а концентрированной кислотой ≥ 98,3% (состав азеотропа). Так как реакция сильно экзотермична, то сначала поглощают SO3 олеумом, а остатки – 98% H2SO4, которые предварительно охлаждают в теплообменниках. В дальнейшим разбавлением олеума можно получать кислоту любой необходимой концентрации.
Дата добавления: 2015-06-17; просмотров: 1480;
