Фтороводородная кислота
Фторводородная (плавиковая) кислота представляет собой раствор фтороводорода в воде.
HF – бесцветный газ с резким, удушающим запахом. Температура плавления и кипения для HF выпадают из ряда соответствующих величин для галогеноводородов и составляют: tпл = –83°C, tкип = +19,5°C (на 100° выше рассчитанных). Это объясняется резким увеличением сил ориентационного взаимодействия между молекулами HF.
Молекула фотороводорода чрезвычайно прочна, гораздо прочнее, чем молекулы других галогеноводородов Eсв = 560 кДж/моль.
Высокая полярность молекулы и образование прочных водородных связей приводят к значительной ассоциации как газообразного, так и жидкого HF вплоть до (HF)6. Причём цепочка HF…HF… построена следующим образом:
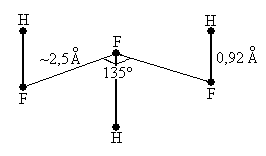
В твёрдом состоянии кристаллы HF содержат подобные бесконечные цепи.
Хотя вода и фтороводород обладают близкими плотностями и диэлектрическими постоянными, их свойства как растворителей различаются чрезвычайно резко. Это является превосходным доказательством ошибочности физической теории растворения и подтверждает правильность гидратной теории растворов Д.И. Менделеева и представлений о роли сольватации в процессах электролитической диссоциации. Последняя связана не только с диэлектрической постоянной растворителя, но и с энергией сольватации образующихся ионов.
Так, например, растворимость фторидов щелочных металлов в HF существенно превосходит их растворимость в воде, а превосходно растворимые в воде галогеноводороды практически нерастворимы в HF.
Диссоциация чистого фтороводорода по схеме
3HF  H2F+ + HF2-
H2F+ + HF2-
протекает незначительно вследствие непрочности образующегося иона гирофторония H2F+. В присутствии воды диссоциация усиливается, так как образуется более прочный ион гидроксония:
2HF + H2O  H3O+ + HF2-
H3O+ + HF2-
Фтороводородная кислота получается при растворении HF в воде. Они смешиваются в любых соотношениях. В системе H2O–HF образуются три гидрата: H2O•HF, H2O•2HF и H2O•4HF. Азеотропная смесь содержит ~35% HF и кипящую при 111°C.
HF – слабая кислота K1 = 4•10-4
Дата добавления: 2015-06-17; просмотров: 2302;
