Азотная кислота и ее соли
В промышленности азотную кислоту получают в три этапа:
4NH3 + 5O2 = 4NO + 6H2O;
2NO + O2 = 2NO2;
4NO2 + O2 + 2H2O = 4HNO3
Азотная кислота и ее соли – сильные окислители.
HNO3 в отличии от других кислот никогда не взаимодействует с металлами с выделением молекулярного водорода H2. В зависимости от концентрации кислоты и активности металла продуктами восстановления азотной кислоты могут быть NO2, NO, N2O, N2, NH3(NH4NO3). Чем менее активен металл и чем большую концентрацию имеет HNO3, тем более вероятно образование NO2 (или NO):
Cu + 4HNO3 (конц) = 2NO2 + Cu(NO3)2 + 2H2O
3Cu + 8HNO3 (разб) = 2NO + 3Cu(NO3)2 + 4H2O
Чем более активен металл и чем меньшую концентрацию имеет HNO3, тем более вероятно образование N2O, N2, NH3 (NH4NO3):
4Mg + 10HNO3(очень разб) = NH4NO3 + 4Mg (NO3)2 + 3H2O
Концентрированная азотная кислота взаимодействует и с неметаллами. При этом образуются оксиды NO2 и NO (так как неметаллы – слабые восстановители), а сами неметаллы как правило окисляются до высших кислот или высших оксидов:
C + 4HNO3 = 4NO2 + CO2 + 2H2O
S + 6HNO3 = 6NO2 + H2SO4 + 2H2O
Смесь концентрированных HNO3 и HCl называется “царская водка”. Царская водка обладает значительно более сильными окислительными свойствами, чем азотная кислота любых концентраций за счет наличия в ней хлористого нитрозила (NOCl) и атомарного хлора:
HNO3 + 3HCl 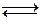 NOCl + 2Cl + 2H2O
NOCl + 2Cl + 2H2O
Все соли азотной кислоты растворимы в воде, при нагревании разлагаются по следующим схемам в зависимости от положения металла в ряду активности:
2KNO3 → 2KNO2 + O2 (от Li до Mg)
2Pb(NO3)2 → 2PbO + 4NO2 + O2 (от Mg до Cu)
2AgNO3 → 2Ag + 2NO2 + O2 (после Cu)
Соли азотной кислоты являются важным сырьем в химической промышленности. Используются для производства удобрений, красителей, нитролаков, взрывчатых веществ, чистых металлов, лекарств, пластмасс, а также широко применяются в пищевой промышленности.
Фосфор
В природе встречаются в виде минералов Ca3(PO4)2 – фосфорит, Ca5(PO4)3F – аппатит. В промышленности фосфор получают прокаливанием руды с песком и углем при температуре 1500оС:
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 5CO + 2P
Фосфор имеет три аллотропные модификации: белый, красный и черный. Белый по внешнему виду похож на воск, очень ядовит, в темноте светится (за счет окисления и выделения энергии в видимой части спектра), хорошо растворим в органических растворителях, легко воспламеняется на воздухе.
Красный фосфор менее реакционноспособен, получается из белого путем нагревания без доступа кислорода. Красный фосфор не ядовит, не растворим в воде и органических растворителях. Нагреванием до 400оС (без доступа воздуха) с последующей конденсацией паров красный фосфор можно перевести в белый.
Черный фосфор внешне похож на графит, хорошо проводит электрический ток (полупроводник). Получается из белого или красного нагреванием без доступа кислорода при давлении 12000 атм. Это наименее реакционноспособная модификация фосфора.
Дата добавления: 2015-04-29; просмотров: 1822;
