Химические свойства. 1. Все реакции N2 с металлами (кроме реакции с литием) идут при довольно сильном нагревании
1. Все реакции N2 с металлами (кроме реакции с литием) идут при довольно сильном нагревании. Исключением является взаимодействие азота с литием, которое начинается уже при комнатной температуре:
N2 + 6Li = 2Li3N
Соединения азота с металлами носят название нитриды. Нитриды активных металлов разлагаются водой:
AlN + 3H2O = Al(OH)3 + NH3
Нитриды тяжелых металлов входят в состав сплавов, повышая их прочность и коррозионную стойкость.
2. С неметаллами азот взаимодействует только при высоких температурах и обратимо. Равновесие как правило сдвинуто влево:
N2 + O2 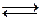 2NO (3700оС);
2NO (3700оС);
N2 + 3H2  2NH3 (400-550оС)
2NH3 (400-550оС)
Реакция получения аммиака имеет большое практическое значение, т.к. аммиак является важным сырьем для химической промышленности. Его синтез идет при давлении 300-500 атм (для смещения равновесия вправо), температуре 400-550оС, в присутствии железо-никелевого катализатора. В лабораторных условиях аммиак можно получить из хлорида аммония:
NH4Cl + NaOH = NH3 + NaCl + H2O
Аммиак – ядовитый газ с резким запахом. При -38оС сжижается. Жидкий аммиак – полярный растворитель, имеющий ряд необычных свойств.
Аммиак очень хорошо растворим в воде: при 20оС в 1 литре воды можно растворить до 800 литров NH3, а при 0оС – около 1200 литров. Молекулы аммиака и воды образуют довольно прочные водородные связи, часть из них соединяются в малоустойчивый гидрат NH3×H2O, который в водном растворе диссоциирует как слабое основание (NH4OH):
NH3 + H2O  NH3×H2O {NH4OH}
NH3×H2O {NH4OH}  NH4 + + OH-
NH4 + + OH-
NH4+ – ион аммония. Все соли аммония прекрасно растворимы в воде.
Для аммиака характерны реакции присоединения, окислительно-восстановительные и замещения.
а) Реакции присоединения:
NH3 + HCl = NH4Cl;
4NH3 + CuSO4 = [Cu(NH3)4]SO4
б) Окислительно-восстановительные реакции:
3CuO + 2NH3 = 3Cu + N2 + 3H2O
2NH3 + 2KMnO4 = 2MnO2 + N2 + 2KOH + 2H2O
в) Реакции замещения:
2NH3 + 2Na = 2NH2Na + H2
NH3 + 2Na = NHNa2 + H2
2NH3 + 6Na = 2NNa3 + 3H2
3. Наиболее практически важным продуктом частичного окисления аммиака является гидразин (N2H4),образующийся при взаимодействии аммиака с перхлоратом натрия:
2NH3 + NaOCl = N2H4 + NaCl + H2O
Как видно из уравнения, под действием окислителя каждая молекула аммиака теряет один атом водорода, а оставшиеся радикалы -NH2 соединяются друг с другом. Следовательно, структурная формула гидразина будет: H2N-NH2. Это бесцветная жидкость, дымящая на воздухе и смешивающаяся с водой в любых соотношениях. Пары гидразина сгорают на воздухе фиолетовым пламенем:
N2H4 + O2 = N2 + 2H2O + 273 кдж/моль
На этой реакции основано использование гидразина в качестве ракетного топлива.
4. С кислородом азот образует пять оксидов: N2O, NO, N2O3, NO2, N2O5.
N2O – оксид азота (I) (закись азота, «веселящий газ») может быть получен разложением нитрата аммония по уравнению:
NH4NO3 = N2O + 2H2O
При 168оС NH4NO3 плавится, при 190оС начинает разлагаться, выше 300оС распад может протекать с взрывом. N2O – несолеобразующий оксид, бесцветный газ со слабым приятным запахом и сладковатым вкусом, довольно хорошо растворим в воде. При нагревании может проявлять окислительные свойства, не ядовит, наркотик.
NO – оксид азота (II) получается в природе при грозовых разрядах. В лабораторных условиях можно получить действием на медь разбавленной азотной кислотой:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
NO – несолеобразующий оксид. Бесцветный газ, малорастворимый в воде. Ядовит. Легко окисляется на воздухе до NO2. Проявляет восстановительные и окислительные свойства, восстановительная функция выражена сильнее.
N2O3 – оксид азота (III) получается в виде синей жидкости в ходе обратимой реакции между NO и NO2, при t = -20оС - -30оС:
NO + NO2  N2O3
N2O3
При комнатной температуре неустойчив, разлагается на NO и NO2. При растворении в воде образует слабую азотистую кислоту HNO2. Как азотистая кислота, так и ее соли неустойчивы и уже на воздухе окисляются до нитратов. Соли и кислота обладают окислительно-восстановительными свойствами:
2KMnO4 + 5NaNO2 + 3H2SO4 = K2SO4 + 2MnSO4 +5NaNO3 + 3H2O
2KJ + 2KNO2 + 2H2SO4 = J2 + 2NO + 2K2SO4 + 2H2O.
Соли азотистой кислоты используются в производстве взрывчатки, красок, в пищевой промышленности (KNO2 – для сохранения цвета мясных продуктов).
NO2 – оксид азота (IV) очень ядовитый газ бурого цвета, склонен образовывать димеры состава N2O4. Сильный окислитель. В лабораторных условиях можно получить действием на медь концентрированной азотной кислотой:
Cu + 4HNO3 (конц) = 2NO2 + Cu(NO3)2 + 2H2O
N2O5 – оксид азота (V) получается при обезвоживании азотной кислоты оксидом фосфора (V):
2HNO3 + P2O5 = 2HPO3 + N2O5
N2O5 - твердое белое вещество, при ударе взрывается. Растворяясь в воде, образует азотную кислоту.
Дата добавления: 2015-04-29; просмотров: 1094;
