Химические свойства. Большинство простых веществ взаимодействуют с кислородом с образованием оксидов
Большинство простых веществ взаимодействуют с кислородом с образованием оксидов. Лишь галогены, инертные газы и элементы платиновой группы не взаимодействуют с молекулярным кислородом. Реакции с кислородом, сопровождающиеся выделением большого количества тепла называются реакциями горения:
S + O2 = SO2;
P4 + 5O2 = 2P2O5;
С + O2 = CO2
2Na + O2 = Na2O2;
2Mg + O2 = 2MgO;
4Al + 3O2 = 2Al2O3
Применение. Кислород используется в промышленности для достижения высоких температур; при сварке и резке металлов в смеси с ацетиленом. Используется в производстве стали (выжигание примесей); в медицине.
Озон
В 1840г. было получено газообразное вещество, состоящее из трех атомов кислорода (О3) и сильно отличающееся по свойствам от обычного кислорода. Новый газ, обладающий характерным запахом, был назван озоном (по-гречески - "пахучий"). Подобно O2, озон представляет собой простое вещество и является аллотропной модификацией кислорода. Для молекулы его вероятна структурная формула
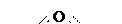
В природе озон образуется в атмосфере при грозовых разрядах из O2. Образуется в верхних слоях атмосферы под действием ультрафиолетового излучения солнца, т.е. только днем. В ночное время концентрация озона падает за счет разложения и взаимодействия с микропримесями различных веществ. Содержание озона в атмосфере на высоте 22 км равно 1.10-6%. Озоновый слой сильно влияет на живую природу Земли, поглощая ультрафиолетовое излучение с длиной волны 220-320 нм, которое смертельно для живой природы.
В жидком и твердом состоянии озон является взрывоопасным веществом. Сильнейший окислитель, взаимодействует с веществами при более низких температурах, чем кислород. Бурно реагирует с органическими веществами. Обладает дезинфицирующими свойствами, токсичен.
Сера
Очень распространена в природе. Встречается как в самородном состоянии, так и в виде многочисленных минералов (FeS2, As2S3, CaSO4.2H2O, Na2SO4.10H2O и т.д.). Это кристаллическое вещество желтого цвета, не растворимое в воде, с температурой плавления 119оС. Полиморфно, наиболее устойчивая модификация - ромбическая, которая при 90оС переходит в моноклинную.
Дата добавления: 2015-04-29; просмотров: 970;
