Производство серной кислоты.
Серная кислота – один из важнейших продуктов химической промышленности. Ежегодное производство около 30 млн. тонн
Основные области применения:
– производство удобрений ~ 40%
– очистка нефти ~ 10%
– производство и очистка синтетических волокон ~ 10%
– травление металлов ~ 4% и др.
H2SO4 получают двумя основными методами:
1. нитрозный (старый) ~ 10%
2. контактный ~ 90%
По следующим стадиям:
I получение SO2 – общая стадия
II SO2 + 1/2O2  SO3
SO3
III SO3 + H2O = H2SO4
I стадия – получение SO2
1. из самородной серы ~ 35%
2. обжигом колчедана (пирита) FeS2 ~ 30%
3. из отходящих газов цветной металлургии ~35% (содержание SO2 2-15%)
Потенциальное сырьё:
а) топочные газы от сгорания угля
Сейчас в мире выбрасывается в атмосферу в 2 раза больше SO2, чем используется при производстве Н2SO4 (высокая стоимость)
б) соли серной кислоты СаSO4•2H2O; Na2SO4•10H2O и т.д.
1. Получение SO2 сжиганием серы
Процесс проходит по следующей реакции
Sт + O2 = SO2 + Q
Фактически сера перед горением плавится и испаряется (tкип = 444°С), горение происходит в газовой фазе в форсуночных или циклонных печах. Процесс ведут в избытке воздуха, и получают газ с содержанием SO2 – 12–16%.
2. Получение SO2 обжигом колчедана
Общая реакция
4FeS2 + 11O2 = 2Fe2O3 + 8SO2 + Q
Процесс идёт через ряд стадий, протекающих в кинетической и диффузионной областях. Основные реакции при обжиге колчедана:
1. термическое разложение колчедана
FeS2 = FeS + S
Эта реакция ускоряется с увеличением температуры, т.к. протекает в кинетической области.
2. горение серы.
S + O2 = SO2
Реакция протекает быстро и при достаточно низкой температуре.
3. окисление сульфидной серы
FeS+ 7O2= 2Fe2O3 + 4SO2
Эта реакция является самой медленной, т.к. протекает в диффузионном режиме.
|
<6000С FeS+ O2 = FeSО4; SO2 + 1/2O2 == SO3
>6000С FeSО4 = FeO + SO3; SO3 = SO2 + 1/2O2
Кинетические кривые скорости горения колчедана выглядят следующим образом


и описываются уравнением: t = 1/k•f(x, β)
k – константа скорости реакции
x – степень обессеривания
β – зависит от состава сырья
Первая стадия – обессеривание и горение серы описываются уравнением
1– 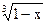 = kτ,
= kτ,
и реакция идёт с увеличением удельной поверхности (накопление продуктов с развитой поверхностью). Энергия активации этой реакции стадии ~100-120 кДж/моль, т.е. реакция идёт в кинетической области.
Вторая стадия – окисление сульфидной серы.
Стадия протекает в диффузионной области. Определяется скоростью диффузии кислорода через оксидную плёнку (x) на поверхность FeS и диффузией SO2 в газовую фазу.

и константа скорости этой реакции зависит от концентрации O2 в газовой фазе и поверхности раздела фаз.
x1= K0•Fn ; x2= K1•C 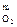
В общем случае скорость процесса можно найти из закона Фика
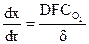
δ= R-r
И общее уравнение можно записать в таком виде
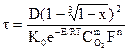
Состав образующегося газа:
а) для горения S
Какова концентрация O2, такова и SO2 – объём на объём.

б) для горения колчедана
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
11 об. O2 – 8 об. SO2 x = 21•8/11= 15,3 объём SO2
21 об. O2(воздух) – x
Если взять 100 объёмов воздуха, то получим
79(N2) +15,3(SO2) = 94,3 объёма
или 15,3/94,3•100% = 16,2% SO2 – теоретический выход
Для того чтобы происходило полное горение, необходимо избыток воздуха. При двойном избытке содержание SO2 ~ 8%. Избыток кислорода необходим также для окисления SO2 в SO3.
Печи для горения колчедана
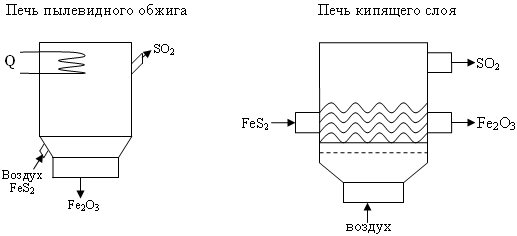
Нитрозный (башенный) способ производства H2SO4.
SO2 в SO3 по этому способу окисляется оксидами азота (эквимольной смесью NO+NO2= N2O3). Получение H2SO4 нитрозным способом протекает в 3 стадии:
- Окисление NO до NO2.
- Поглощение окислов азота серной кислотой.
- Взаимодействие SO2 с нитрозой.
Дата добавления: 2015-06-17; просмотров: 1202;
