Схема производства следующая

1. печь обжига извести
2. гашение извести
3. барботажная абсорбционная колонна
4. карбонизационная колонна
5. промывка газа
6. компрессор
7. фильтр
8. печь кальцинации
9. колонна регенерации
В общем виде уравнение изотермической кристаллизации при 15°С выглядит следующим образом
Х NаCl + Y NH4HCO 3 + Z H2O = V NaHCO3 + 1 моль раствора т. Р1
Состав т. Р1 Na+ = 0,186; Cl- = 0,880
NH4+ = 0,814; HCO3- = 0,120
Составлямт частное уравнение по каждому иону
По Na+ Х = V (в осадке) + 0,186 (в растворе)
По Cl- Х = 0,88 весь в растворе
По NH4+ Y = 0814 весь в растворе
По HCO3- Y = V + 0,12
По H2O Z = 7,2 моля на 1 моль сухого остатка
V = Х – 0,186 = 0,88 – 0,186 = 0,694 моль
V – количество, которое перешло в осадок
Значит надо смешать 0,88 моль NаCl, 0,814 моль NH4HCO3 и 7,2 моль H2O, чтобы получить 0,694 моль NaHCO3.
Чтобы произошла реакция необходимо взять избыток NaCl
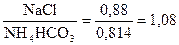
Коэффициенты использования Na+ и NH4+ равны
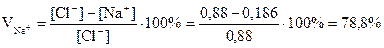

При 32°С VNa+ = VNH4+ = 84%
По метастабильной диагонали рассчитывают соотношение исходных солей.
Схема производства предусматривает следующие этапы.
- Обжиг известняка с целью получения CO2 . Получение известкового молока.
Обжиг CaCO3 = CaO + CO2 – Q
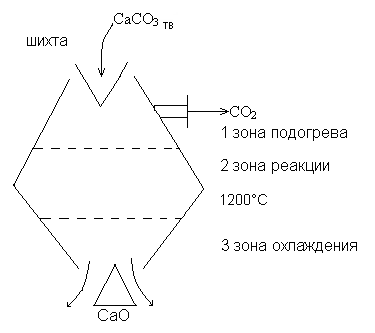
При 700-800°С в 1 зоне начинается горение кокса и разложение CaCO3.
Обжиг – диффузионный процесс, на который влияют температура и поверхность материала.
При температуре выше 1200°С могут образовываться соединения типа CaO•SiO2; CaO•Te2O3, которые имеют выход CO2 и в дальнейшем Са(OH)2.
Куски не должны быть меньше 40-80 мм иначе будет велико сопротивление выходящим газам. Реакция обмена чистого CaCO3 протекает со 100% выходом уже при 900-1000°С, но присутствие примесей вынуждает проводить эту реакцию при 1200°С.
2. Очистка рассола NаCl от примесей
3. Абсорбция – насыщение рассола аммиаком и частично CO2
Насыщение заключается в приготовлении аммонизированного рассола такой концентрации, которая требуется для дальнейшей карбонизации.
На абсорбцию поступает NH3 и CO2. При этом происходит следующие реакции
* 2 NH3 + CO2 + H2O = (NH4)2CO3
NH3 + H2O = NH4OH
4. Карбонизация – насыщение аммонизированного рассола CO2
Насыщение рассола CO2 с образованием суспензии NаHCO3
* (NH4)2CO3 + CO2 + H2O → 2NH4HCO3
NH4HCO3 + NH4OH → (NH4)2CO3 + H2O
2NаHCO3 +2 NH4OH → Nа2CO3 + (NH4)2CO3 + 2H2O
Nа2CO3 + CO2 + H2O → 2NаHCO3
* NаCl + NH4HCO3  NаHCO3 + NH4Cl
NаHCO3 + NH4Cl
* – основные реакции
5. Выделение NаHCO3 от маточного раствора на фильтрах
6. Регенерация NH3
Регенерация производится из маточного раствора содержащего (NH4)2CO3, NH4HCO3 (полусвязанный NH3), NH4Cl (связанный NH3).
При температуре 72-74°С происходит регенерация полусвязанного аммиака
(NH4)2CO3 → 2 NH3 + CO2 + H2O
NH4HCO3 → NH3 + CO2 + H2O
В колоне регенерации происходит освобождение связанного аммиака
2NH4Cl + Ca(OH)2 → 2NH3 + H2O + CaCl2
Освобождающиеся NH3 и CO2 поступают в абсорбционную колонну.
В растворе остаются CaCl2 и NаCl
7. Кальцинация – разложение NаHCO3 .
Реакцию проводят при 140-160°С в печах.
2NаHCO3 → Nа2CO3 + CO2 + H2O
(NH4)2CO3 → 2NH3 + CO2 + H2O
CO2 снова поступает в производство. Все маточные растворы также регенерируют.
Дата добавления: 2015-06-17; просмотров: 1119;
