Производство кальцинированной соды.
В настоящее время производство Na2CO3 составляет примерно 6 миллионов тонн. Она находит применение в металлургической, стекольной, пищевой, целлюлозно-бумажной, текстильной, нефтяной отраслях промышленности и т.д.
Промышленность выпускает несколько типов содопродуктов:
Nа2CO3 безводный – карбонат натрия, кальцинированная сода
NаHCO3 – бикарбонат натрия, пищевая сода
Nа2CO3•ωH2O – кристаллическая сода
Nа2CO3•H2O – тяжелая сода
В настоящее время существуют 2 промышленных способа производства соды
1. из щелочей алюминиевого производства
(около 10% Nа2CO3, 5% K2CO3, 5% K2SO4 – дробная кристаллизация)
2. основной способ – аммиачный
(метод Сольбе) теоретические основы метода заложены русским ученым Федотьевым.
Сырье: насыщенный раствор NaCl, NH3 и CO2.
В основе процесса лежит реакция:
1) NaCl + NH3 + CO2 + H2O = NaHCO3 + NH4Cl
2) далее: 2 NaHCO3 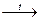 Na2CO3 + CO2 + H2O
Na2CO3 + CO2 + H2O
Исходные газы получают следующим образом:
CaCO3 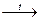 CaO + CO2
CaO + CO2
CaO + H2O = Ca(OH)2
NH4Cl + Ca(OH)2 = NH3 + H2O + CaCl2
Реакция (1) является суммарной для следующих процессов
А) 2NH3 + CO2 + H2O = (NH4)2CO3
Б) (NH4)2CO3 + CO2 + H2O = 2NH4HCO3
В) NaCl + NH4HCO3  NaHCO3 + NH4Cl
NaHCO3 + NH4Cl
Последняя реакция является основной, и выход продукта определяется условиями её проведения.
Насыщенный СО2 аммиачно-солевой раствор представляет собой сложную двухфазную систему: жидкая фаза представляет собой раствор солей NаCl, NH4Cl, NaHCO3, NH4HCO3, (NH4)2CO3; твердая фаза – NaHCO3.
Степень осаждения бикарбоната натрия зависит от следующих условий:
1. от соотношения NaCl и NH3 в растворе
– с уменьшением соотношения NaCl / NH3 степень осаждения NaHCO3 возрастает
2. количества воды в системе
– с увеличением количества воды больше NaHCO3 будет находиться в растворе, то есть уменьшается выход продукта.
3. степень насыщения раствора СО2
– она должна быть ближе к соотношению СО2 : NH3 в молекуле NH4HCO3, при этом больше осаждается NaHCO3 из раствора, т.к в присутствии NH4HCO3 растворимость NaHCO3 уменьшается.
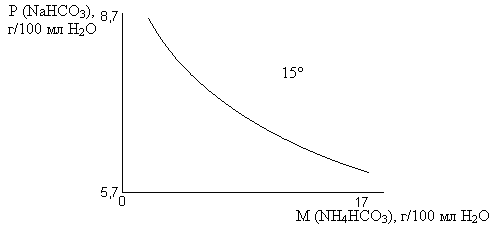
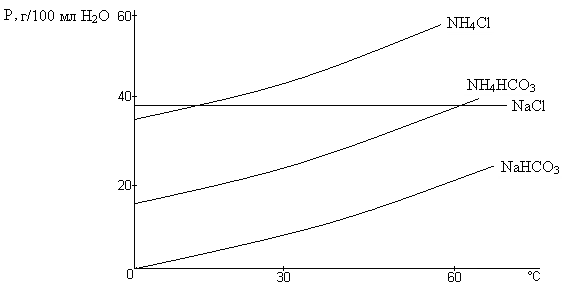
Растворимость NaHCO3 наименьшая из всех солей
Для характеристики процесса вводят коэффициент использования ионов Na+ и NH4+
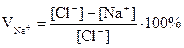
VNa+ характеризует степень превращения NаCl в осадок NaHCO3
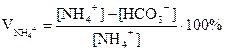
V NH4+ характеризует степень превращения NH4HCO3 в NaHCO3
[Na+]; [Cl-]; [NH4+] и [HCO3-] – концентрации ионов в маточном растворе
При 32°С V Na+ = V NH4+ = 84%
При 15°С V Na+ = 78,8%
V NH4+ = 85,1%
Практический выход составляет примерно 70%.
Дата добавления: 2015-06-17; просмотров: 1510;
