Производство нитрата калия
Нитрат калия KNO3 (калийная селитра) используется в производстве порохов, в пиротехнике, в пищевой и стекольной промышленности и как удобрение.
KNO3 можно производить несколькими методами. Самые простые методы: нейтрализация КОН или К2CO3 азотной кислотой или абсорбция калиевыми щелочами нитрозных газов широко не распространены, вследствие дороговизны исходных калиевых соединений.
Наибольшее промышленное распространение имеет конверсионный способ получения нитрата калия. Этот способ основан на обменном разложении NаNO3 и КCl:
NаNO3 + КCl  NаCl + KNO3
NаCl + KNO3
NаNO3 получают путем щелочной абсорбции выхлопных нитрозных газов, при производстве азотной кислоты, КCl из сильвинита или других калийных солей.
Диаграмма состояния солей, участвующих в реакции – это четырехугольник. В поле расположены поля кристаллизации солей – участников реакции и изотермы кристаллизации при 25 и 100°С. Из диаграммы видно, что поле кристаллизации при 25°С самое большое у KNO3, а при 100°С – самое маленькое (оно уменьшается примерно в 3 раза, что очень важно для технологии).
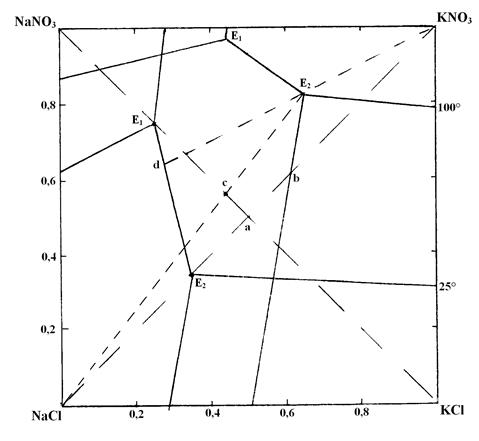
Процессы кристаллизации проходят также как и в системе NaCl–NаHCO3–NH4HCO3–NH4Cl, свойства диаграммы те же. В данном случае NaNO3–KCl – метастабильная диагональ, NaCl–KNO3 – стабильная диагональ.
Если приготовить раствор эквимолекулярной смеси КCl и NаNO3 при 100°C, то фигуративная точка (точка а) системы окажется в поле кристаллизации NаCl, и он начнёт выпадать из раствора при его выпаривании, состав смеси будет меняться по ав. Если выделить осадок NaCl и охладить раствор до 25°C, то начнёт кристаллизоваться KNO3 (точка будет лежать в его поле). Состав будет меняться по линии в Е225.
Однако при таком пути кристаллизации выход KNO3 мал. Наибольший выход получается, если к концу выделения NaCl раствор будет насыщен NaCl, KCl, KNO3 (точка Е2100). Значит необходимо взять исходную смесь солей в точке С: Nа+ – 0,58 , К+ – 0,42, Cl- – 0,42, NO3- – 0,58, т.е. избыток NаNO3. Тогда после отделения кристаллов NаCl и охлаждения кристаллизация KNO3 будет идти по наиболее длинному пути (Е2100) и будет максимальный выход продукта.
Дата добавления: 2015-06-17; просмотров: 4105;
