Метод галлургии (или метод растворения и кристаллизации)
В основе этого метода лежат свойства системы KCl–NaCl–H2O.
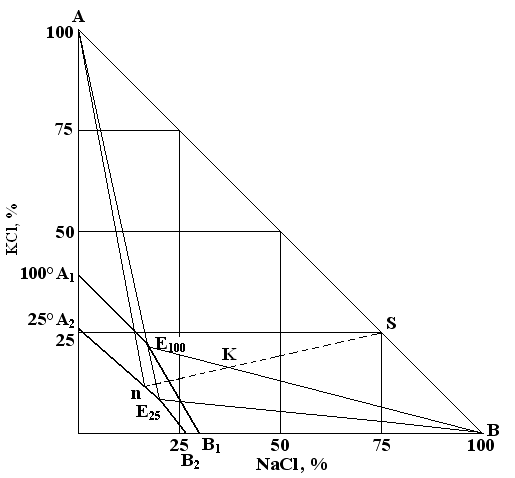
На диаграмме изображены пропорции при 25оС (А2Е25В2) и 100оС (А1Е100В1). Точки Е25 и Е100 называются эвтоническими точками – точки совместного насыщения раствора обоими солями. Линии В2Е25 и В1Е100 – отвечают растворам, насыщенным NaCl, линии А2Е25 и А1Е100 – растворам, насыщенным KCl. Поле кристаллизации, KCl находится внутри треугольника А2Е25А, поле кристаллизации NaCl – В2Е25В.
Фигуративная точка системы, соответствующая составу Е100 при 100°C, при охлаждении оказывается в поле кристаллизации KCl и в осадок выпадает KCl. При охлаждении до 25°C состав раствора меняется по линии Аn от Е100 до n. Если после отделения осадка KCl раствор снова нагреть до 100о, точки оказываются ненасыщенными по KCl, и при обработке им сильвинита из него растворяется KCl и остается NaCl. Такой путь повторяется многократно, и в результате чего сильвинит разделяется на KCl и NaCl.
Для полного выделения KCl из сильвинита необходимо, чтобы его количество, вводимое в цикл, соответствовало количеству щелочи. Если принять состав сильвинита 25% KCl и 75% NaCl (точка S), то точки смеси его со щёлочью лежат на прямой Sn. Выбирают смесь, которая полностью разделяется при соприкосновении со щёлочью на Е100 и твёрдый NaCl. Этому условию соответствует смесь К, лежащая на пересечении Sn и Е100В и соотношение:
n(количество щелочи)/S(количество сильвинита) = SK/Kn
Дата добавления: 2015-06-17; просмотров: 1235;
