Электрохимический метод получения водорода
Метод заключается в электролизе водный растворов кислот или щелочей с целью получения H2 и O2. Этот метод разработан в 1789 году и развит в тех странах, где дешёвая электроэнергия. Производство энергоёмкое, но сам способ самый дешёвый и простой.
Чистая вода имеет очень малую электропроводность вследствие того, что только ничтожное количество молекул воды диссоциирует на ионы
H2O  H+ + OH-
H+ + OH-
Константа диссоциации воды KW = 10-14 (при 25°C). Удельная электропроводность воды также мала æ = 10-8 Ом-1∙см-1. Поэтому электролиз ведут не чистой воды, а растворов кислот или щелочей.
Например:
1. Раствор H2SO4.
Диссоциация в растворе
H2SO4  2H+ + SO
2H+ + SO 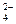 полностью
полностью
H2O  H+ + OH- очень мало
H+ + OH- очень мало
на К (–) 2H+ + 2ē = H2↑
на А (+) Возможны реакции:
2OH- – 2ē = H2O + ½O2 E 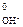 = 0,41 В
= 0,41 В
SO 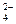 – 2ē + H2O = H2SO4 + ½O2 E
– 2ē + H2O = H2SO4 + ½O2 E 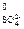 = 1,96 В
= 1,96 В
H2O – 2ē = 2H+ + ½O2 E 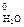 = 1,23 В
= 1,23 В
Отсюда должны разряжаться ионы OH-, но их очень мало, и идёт реакция 3.
2. Раствор NaOH.
Диссоциация в растворе
NaOH  Na+ + OH- полностью
Na+ + OH- полностью
H2O  H+ + OH- очень мало
H+ + OH- очень мало
на А (+) 2OH- – 2ē = H2O + ½O2
на К (–) Возможны реакции:
2H+ + 2ē = H2↑ E 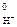 = 0,41 В
= 0,41 В
Na+ + ē = Na E 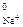 = –2,7 В
= –2,7 В
H2O + 2ē = H2 + 2OH- E 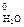 = 1,23 В
= 1,23 В
Также как и в случае раствора кислоты здесь идёт в основном реакция 3.
Но суммарная реакция в обоих случаях одна:
H2O 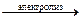 H2 + ½O2
H2 + ½O2
– идёт разложение воды, а ионы кислоты или щёлочи служат переносчиками электричества.
Характерной особенностью электролиза воды является также то, что разлагается только лёгкая вода – H2O, в то время как тяжёлая вода – D2O остаётся в растворе. В обычной воде содержание D2O – 0,02%. В процессе электролиза происходит накопление тяжёлой воды в растворе, затем её выделяют ректификацией (tкип = 101,4°C). Электролитическая установка мощностью 1 МВт может дать до 80-100 кг D2O в год.
Количество полученных H2 и O2 определяется количеством пропущенного электричества. По закону Фарадея для разложения 1 г-экв любого вещества необходимо затратить 96500 Кл электричества. По уравнению электролиза
2F H2O = H2 + ½O2
для разложения 1 г-моля H2O необходимо затратить
96500∙2 = 193000 Кл (А∙сек) или 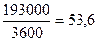 А∙ч
А∙ч
При затрате 1 А∙ч выделяется
V(H2) = 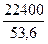 = 418 см3 и V(O2) =
= 418 см3 и V(O2) = 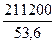 = 209 см3
= 209 см3
Производительность ванный по водороду составляет
W = 418Iτ
I – сила тока, τ – время электролиза.
Отсюда, для получения 1 м3 (106 см3) H2 и 0,5 м3 O2 необходимо теоретические затратить электроэнергии
Iτ = 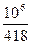 = 2390 А∙ч
= 2390 А∙ч
Теоретическая ЭДС ванны по уравнению Гиббса-Гельмгольца
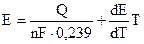
Q – тепловой эффект для 1 г-моля H2O, n – число г-экв разлагающегося вещества, 0,239 – тепловой коэффициент электрической энергии, 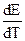 – температурный коэффициент ЭДС.
– температурный коэффициент ЭДС.
Получаем E = 1,23 В. На практике E ~ 3 В.
Электролитами для электролиза воды могут служить H2SO4, NaOH, KOH, Na2CO3, но обычно KOH.
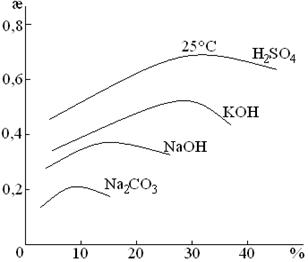
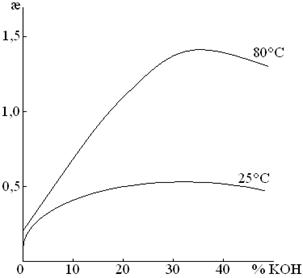
Выбор в качестве электролита KOH обусловлен тем, что в условиях электролиза электроды можно изготовлять из простой конструкционной стали. Концентрация электролита 29% KOH или 17% NaOH, так как у этих растворов максимальная æ.
Для получения 1 м3 H2 и 0,5 м3 O2 необходимо затратить
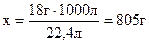 H2O
H2O
Практически же расходуется больше воды, так как при высоких температурах происходит испарение и унос воды с газом.
Дата добавления: 2015-06-17; просмотров: 2022;
