Пирометаллургический метод
Этот метод получил наибольшее распространение (перерабатывается до 80% меди). Он основан на большем сродстве Cu к сере, а других компонентов – к кислороду.
Производство складывается из следующих операций:
1. обогащение;
2. обжиг;
3. плавка;
4. конвертирование;
5. огневое рафинирование;
6. электролитическое рафинирование.
1) Флотационное обогащение приводит к возрастанию содержания меди до 20% (по сульфиду).
2)  Обжиг осуществляетсяв печах пылевидного топлива или в печах кипящего слоя: при этом происходят реакции:
Обжиг осуществляетсяв печах пылевидного топлива или в печах кипящего слоя: при этом происходят реакции:
FeS2 = FeS +S
S + O2 = SO2↑
FeS + O2 = Fe2O3 + SO2↑
Cu2S + O2 = Cu2O + SO2↑ (частично)
Cu2O + FeS = Cu2S + FeO
В шихту вводят SiO2 и CaCO3 для предотвращения спекания. В огарке получается FeO и Cu2S (+ примеси); As, Sb, Zn, Pb частично уходят с газами.
3) Плавка огарка на штейн предусматривает отделение пустой породы и окислов. Температура процесса 1500-1600°С. Плавка окислительная и проводится в отражательных печах:
FeS + SiO2 + O2 = 2FeO∙SiO2 + SO2 ↑
Cu2S + O2 = Cu2O + SO2↑
Cu2O + SiO2 + FeS = 2FeO∙SiO2 + Cu2S
Шлак с расплава сульфидов сливают, и штейн отправляется в конверторы на продувку.
4) Конвертирование (продувка штейна в конверторах).
I продувка 2FeS + 3O2 = 2FeO + 2SO2↑ + Q
2FeO + SiO2 = 2FeO∙SiO2 + Q
Cu2O + FeS = Cu2S + FeO + Q
Шлак убирается.
II продувка 2Cu2S + 3O2 = 2Cu2O + 2SO2↑ + Q
Cu2S + 2Cu2O = 6Cu + 2SO2↑
После перехода меди в металлическую форму её разливают и рафинируют (очищают примесей).
5) Огневое рафинироание.
Полученную медь продувают воздухом:
Cu + O2 = Cu2O
Cu2O + Me = MeO + Cu
То есть металлы имеющие при данной t° большее сродство к кислороду всплывают в шлак. Полученная черновая медь содержит 95-98% Cu. Если в ней содержатся Ag, Au, Se, Tc, Bi, Fe и другие металлы, то её подвергают электрохимическому рафинированию.
6) Электрохимическое рафинирование.
При этом удаляются почти все примеси
«+» : Сu – 2ē → Cu2+ E = + 0,34 В
Сu – ē → Cu+ E = + 0,51 В
Сu+ – ē → Cu2+ E = + 0,17 В
В растворе Cu2+ + Cu  2Cu+
2Cu+
 Kp =
Kp = 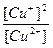 = 10-6
= 10-6
Если [Cu2+] = 1г-ион/л, [Cu+] = 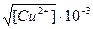
Следовательно, рафинирование идёт в виде Cu+ и Cu2+.
«–» Cu2+ + 2ē → Cuo
В каком же случае будет равновесие
ECu2+/Cu+ = 0,17 + 0,059lg 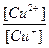 = 0,17 + 0,059lg10-3 ≈ 0,34 В
= 0,17 + 0,059lg10-3 ≈ 0,34 В
Таким образом, равновесие этой реакции соблюдается при E = 0,34 В. Оно может нарушаться за счёт окисления кислородом воздуха:
2Cu+ +2H+ + ½ O2 = 2Cu2+ + H2O
Cu + 2H+ + ½ O2 = Cu2+ + H2O
Cu2SO4 + H2O = Cu2O + H2SO4 → CuSO4 + Cu + H2O
Все примеси, имеющиеся в меди можно разделить на 3 группы:
1. более электроотрицательные, например, Zn, Fe, Ni. Они переходят в электролит и накапливаются в нём;
2. более электроположительные, например Ag, Au, Pt. Они не растворяются и переходят в шлам.
3.  потенциал близок к потенциалу растворения меди (As, Sb, Bi и другие). Они переходят в раствор и затем в нём гидролизуются и выпадают в шлам.
потенциал близок к потенциалу растворения меди (As, Sb, Bi и другие). Они переходят в раствор и затем в нём гидролизуются и выпадают в шлам.
Состав электролита:
CuSO4 120-150 г/л,
H2SO4 150-180 г/л
T = 50°C, i = 200 А/м2
Гидрометаллургический метод (переработка окисленных руд)
Медь в таких рудах находится в виде оксидов, карбоната, гидроксида. Её извлекают методом электроэкстракции, по которому сначала руду обрабатывают кислым раствором:
Cu2+ +H2SO4 = CuSO4 + 2H+
Далее ведут электролиз с нерастворимым анодом.
«+» Pb┃CuSO4,H2SO4┃Cu «–»
На аноде: «+» Pb – 2ē = Pb2+ E° = – 0,15 В
2H2O – 4ē = O2↑ + 4H+
Затем Pb2+ + SO42– =PbSO4 ↓
часть Pb2+ – 2e- = Pb4+ (Pb(SO4)2↓)
и гидролиз Pb(SO4)2
Pb(SO4)2 + H2O  PbO2↓ +H2SO4
PbO2↓ +H2SO4
PbO2 оседает в порах PbSO4, образуя прочный проводящий слой, и в дальнейшем анод не растворяется, и на нём поверхности идёт только разложение воды.
На катоде: «–» Cu2+ + 2ē = Cuo
Плотность тока на катоде Ik = 150-200 A/м2.
Дата добавления: 2015-06-17; просмотров: 1044;
