Производство алюминия. Алюминий – самый распространённый металл в природе (общее содержание в земной коре ~8,8 %)
Алюминий – самый распространённый металл в природе (общее содержание в земной коре ~8,8 %). Электрохимический способ получения алюминия открыт в 1886 году, сейчас способ тот же, но аппаратурное оформление – современное. Ежегодное производство ~3 млн. тонн. Алюминий используется в авиа- и автостроении в виде сплавов с Mn, Mg, Cu, Si, Ni, Zn, а также широко используется в электротехнической промышленности (провода). В СССР ~12 заводов по производству Al, 2 на Урале (БАЗ, УАЗ).
Сырьё для производства:
1. Бокситы Al2O3 – 50-60%, SiO2 + Fe2O3 + TiO2 – 5-10%, H2O – 10-30%;
2. Нефелин 3Na2O×K2O×4Al2O3×9SiO2;
3. Алунит K2SO4×Al2(SO4)3×4Al(OH)3;
4. Каолин Al2O3 ~ 40% (также содержит SiO2) – из них выгодно сразу получать силумин (сплав Al+Si);
Электролитом для производства Al служит расплав глинозёма с криолитом Al2O3+Na3AlF6.
I. Получение глинозёма.
1) Метод Байера (из бокситов, Si< 4%).
Необходимо избавиться от Fe, Si, Ti:
Al2O3 + 2NaOH → 2NaAlO2 + H2O (раствор)
SiO2 + 2NaOH → Na2SiO3 + H2O (раствор)
Часть Al уходит в осадок (побочная реакция):
NaAlO2 + Na2SiO3 ® Na2O×Al2O3×2SiO2↓
Поэтому, чтобы было меньше потерь Al, перерабатывают сырьё содержащее мало SiO2. Далее:
NaAlO2 + 2H2O = Al(OH)3↓ + NaOH
2Al(OH)3 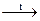 Al2O3 + 3H2O
Al2O3 + 3H2O
Все процессы, кроме обжига, проводят в растворе.
2) Метод Яковкина и Линеева.
Метод применим к сырью, содержащему много SiO2. Он основан на спекании нефелина с известняком при Т = 1000-1200°С. При этом образуются NaAlO2, NaFeO2 (алюминат и феррит натрия), CaSiO3.
Al2O3 + Na2CO3 → Na2O∙Al2O3 + CO2↑ T = 700°C
Fe2O3 + Na2CO3 → Na2O∙Fe2O3 + CO2↑ T=700° C
Na2O∙Fe2O3 + Al2O3 → Na2O∙Al2O3 + Fe2O3 T>900° C
Na2O∙Al2O3 + 2SiO2 → Na2O∙Al2O3∙2SiO2 T>900° C
Затем
Na2O∙Al2O3∙2SiO2 + 2CaO → Na2O∙Al2O3 + 2CaSiO3 (2CaO∙SiO2)
Получают смеси: Na2O∙Al2O3, Na2O∙Fe2O3, CaSiO3 (2CaO∙SiO2), Na2O∙SiO2.
Эти смеси размалывают и выщелачивают, при этом в раствор переходят силикат и алюминат натрия, в отвал – Fe2O3, CaSiO3.
Добавляют известковое молоко и отводят CaO∙Al2O3∙2SiO2 в осадок.
Далее идут стадии карбонизации 2NaAlO2 + CO2 + 3H2O → 2Al(OH)3↓ + Na2CO3
и обжига 2Al(OH)3 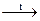 Al2O3 + 3H2O
Al2O3 + 3H2O
II Получение криолита.
Его получают искусственным путём из флюоритов (CaF2+SiO2)
Схема процесса:
CaF2 + H2SO4 = CaSO4 + 2HF↑
SiO2 + 4HF = SiF4 + H2O побочная реакция
SiF4 + 2HF = H2SiF6 побочная реакция
6HF + Al(OH)3 = H3AlF6 + 3H2O
2H3AlF6 + 3Na2CO3 = 2 Na3AlF6 + CO2↑ +3H2O
Осадок фильтруют и сушат.
Дата добавления: 2015-06-17; просмотров: 997;
