Электролит для получения алюминия.
Al2O3 – Tпл = 2050°С, Na3AlF6 – Tпл = 1010°С – основные компоненты
 Сам глинозём не электропроводен, поэтому его необходимо растворить в криолите
Сам глинозём не электропроводен, поэтому его необходимо растворить в криолите
Судя по этой диаграмме, в криолит добавляют 10-15% глинозёма и проводят электролиз при 950-960°С. Для улучшения электропроводности ещё добавляют AlF3, для улучшения смачиваемости электродов – NaF. Электролит готовят таким образом, чтобы dAl > dэлектролита ~10%. Это предотвращает всплывание Al и его последующее окисление.
Таким образом, в расплаве имеются Na3AlF6, Al2O3, AlF3, NaF; происходит диссоциация:
Na3AlF6  3Na+ + AlF63-
3Na+ + AlF63-
NaF  Na+ + F-
Na+ + F-
Al2O3  Al3+ + AlO23-
Al3+ + AlO23-
2Al2O3  Al3+ + 3AlO2-
Al3+ + 3AlO2-
AlF3  Al3+ + 3F-
Al3+ + 3F-
При 1000°С напряжение разложения составляет для NaF = 4,6-4,9В, для AlF3 = 3,4-3,7В, для Al2O3 = 2,2В. Наименьшее напряжение разложения у Al2O3, поэтому протекает следующий процесс на электродах:
К “-“ : Al3+ + 3ē → Al (из глинозёма)
А “+” : 2AlO33- – 6ē → Al2O3 + 1,5O2↑
2AlO2- – 2ē → Al2O3 + 0,5O2 ↑
Затем
С + O2 = СO2
С + СO2 = 2CO↑
2F- – 2ē = F2↑
В основном расходуется глинозём, поэтому его периодически добавляют. Образующийся Al отсасывают вакуум-ковшами.
Схема электролизёра:
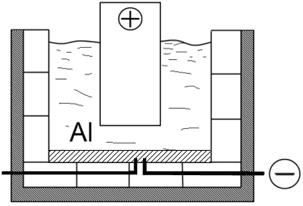
Понижение выхода по току происходит вследствие побочных процессов:
1. растворение Al в электролите: Al3+ + 2Al  3Al+;
3Al+;
2. окисление Al: 4Al + 3O2 = Al2O3;
3. образование карбида: 4Al + 3C = Al4C3;
4. выделение на катоде примесей (Si, Na, Ti, Fe и других).
На 1 тонну Al расходуется 16200 кВт∙ч электроэнергии, причём ~80% на сырьё. Al извлекают из электролизёра и подвергают рафинированию.
1) Продувание Cl2 через расплав.
Образуется AlCl3, он адсорбирует примеси и всплывает на поверхность.
2) Электрохимическая ячейка.

Электролит BaCl2 + NaF + AlF3
на “–“ Al3+ + 3ē = Al
на “+” Al – 3ē = Al3+
Более электроотрицательные Ме растворяются в первую очередь и накапливаются в электролите, более электроположительные (Si, Fe, Cu) – оседают на аноде
Дата добавления: 2015-06-17; просмотров: 1043;
