Производство щёлочи и хлора электролизом раствора поваренной соли
Щёлочь NaOH наряду с серной и азотной кислотами является основным продуктом химической промышленности. Ежегодное производство составляет более 3 млн. тонн. Она находит применение практически во всех отраслях промышленности.
NaOH можно получать трёмя способами:
1. Известковый способ.
Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH
t = 80–100°C, концентрация щёлочи 100-120 г/л
2. Ферритный способ.
Fe2O3 + Na2CO3 = NaFeO2 + CO2
t = 800–1000°C
2NaFeO2 + H2O = 2NaOH + Fe2O3
3. Электролитический способ (основной)
Метод электролиза раствора поваренной соли. В этом случае совместно с NaOH получаются Cl2 и H2. Области применения Cl2 также велики:
– химическая промышленность – получение солей, HCl кислота
– органический синтез – получение органических соединений
– металлургия – хлорирование руд
– текстильная промышленность – отбеливатели и т.д.
Существуют два основных способа осуществления электрохимического метода:
- Электролиз с твёрдым катодом
- Электролиз с жидким катодом (при этом способе получается щёлочь более высокой чистоты)
Каждый из перечисленных методов имеет свои достоинства и недостатки, и выбор метода определяется, в основном, его экономичностью. В настоящее время вся щёлочь получается электрохимическим методом, так как наряду с ней получают ещё и Cl2 и H2.
Сырьё.
Сырьём для производства NaOH является поваренная соль, которая встречается в природе в виде каменной соли и осадочной соли (соляные озёра). Основные месторождения: Артёмовское, Илецкое, Соликамское, Березняки. Содержание NaCl ~97-99%. Примеси – ионы Ca2+ и Mg2+. Соли Ca и Mg – вредные примеси, они забивают диафрагмы, и от них избавляются обработкой содой и щёлочью, получая CaCO3 и Mg(OH)2. После фильтрования расколы поступают на производство.
- Электролиз с твёрдым катодом.
При этом способе реализуется ячейка
– Fe│NaCl (H2O)│C +
В растворе диссоциируют:
NaCl  Na+ + Cl–
Na+ + Cl–
H2O  H+ + OH–
H+ + OH–
На катоде 
1). Na+ + ē → Na E0 = –2,7 В
2). 2H+ + 2ē → H2↑ E0 = –0,41 В
3). 2H2O + 2ē → H2 + 2OH– Ep = –0,9 В
Так как в данном случае ионов H+ в растворе очень мало, то идёт, в основном, реакция 3.
На аноде 
1). 2Cl– – 2ē → Cl2 Ep = 1,33 В
2). 2OH– – 2ē → H2O + ½O2 Ep = 0,48 В
3). 2H2O – 4ē → O2 + 4H+ Ep = 0,81 В
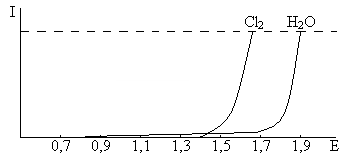
На аноде слабокислая среда, и поэтому ионов OH– практически нет. Если судить о равновесных потенциалах, то будет идти реакция 3, но с учётом перенапряжения
Eвыд = Ep + η
η(Cl2) = 0,25 В на графите при i = 1000 А/м2, η(H2O) = 1,09 В, C = 310 г/л. Тогда E выделения Cl2 и H2O – 1,58 В и 1,90 В соответственно. Значит, на аноде будет выделяться Cl2.
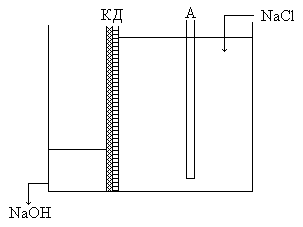
Диафрагмы
Диафрагма – это пористая перегородка, отделяющая анодное пространство от катодного. От качества диафрагмы зависит выход по току и расход электроэнергии. Диафрагма должна быть устойчива к действию щёлочи, кислоты, Cl2. Она не должна оказывать большого сопротивления электрическому току и обеспечивать равномерность фильтрации электролита через неё. В качестве диафрагмы применяют асбест. Листы асбеста накладывают на сетчатые катоды со стороны анода.
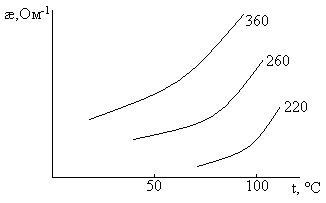
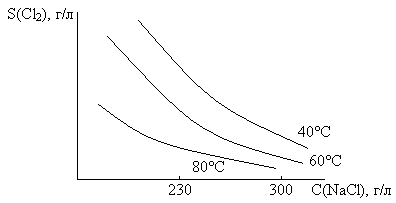
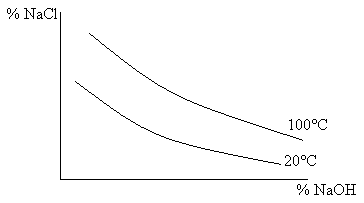
Электролиз раствора ведут при концентрации NaCl ~300-310 г/л (насыщение), так как:
1). Увеличение концентрации и температуры приводит к увеличению электропроводности
2). Растворимость Cl2 в воде значительно уменьшается с увеличением температуры и концентрации
Выход по току NaOH сильно зависит от концентрации щёлочи
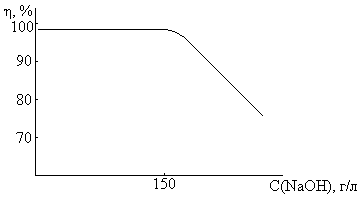
При нарушении VNaCl>VOH диафрагмы заменяют
Для извлечения NaOH из раствора NaCl его упаривают и фильтруют NaCl
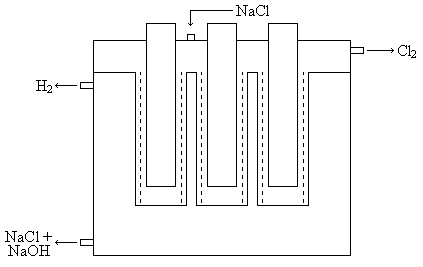
Сырой хлор очень агрессивен, поэтому его вначале осушают (H2SO4), потом транспортируют в стальным баллонах. Схема ванны:
- Электролиз с жидким катодом.
Жидким катодом при электролизе является ртуть. Тогда схема ячейки будет следующая
– Hg│NaCl (H2O)│C +
– Hg Na│NaCl (H2O)│C +
На ртути разлагается не водород, а натрий, и образуется амальгама.
Процессы на электродах:
На аноде  возможны реакции
возможны реакции
2Cl– – 2ē → Cl2 Ep = 1,33 В
2H2O – 4ē → O2 + 4H+ Ep = 0,81 В
Должен выделяться O2. Перенапряжение выделения этих веществ при i = 1000 А/м2 равны 0,25 В и 1,09 В для хлора и кислорода соответственно (η(Cl2) = 0,25 В, η(O2) = 1,09 В). Тогда потенциалы выделения составят
Ер(Cl2) + η(Cl2) = 1,33 + 0,25 = 1,58 В
Ер(O2) + η(O2) = 0,81 + 1,09 = 1,90 В
Так как потенциал выделения для ионов хлора будет более электроотрицателен, то он будет выделяться на аноде в первую очередь.
На катоде  возможны реакции
возможны реакции
2H2O + 2ē → H2 + 2OH– Ep = –1,63 В
Na+ + ē → Na E0 = –1,7 В
Потенциалы приблизительно одинаковы. Таким образом, суммарный процесс:
2H2O + 2ē → H2 + 2OH–
2Cl– – 2ē → Cl2

2Cl– + 2H2O = H2 + Cl2 + 2OH–
или 2NaCl + 2H2O = H2 + Cl2 + 2NaOH
Для поддержания концентрации натрия в ртути меньше 0,25% электролизные ванны имеют следующий вид:
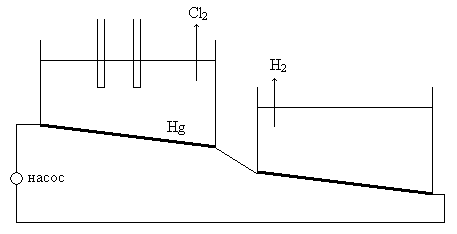
Побочные процессы
1. Выделение O2
2H2O – 4ē → O2 + 4H+
2. Cl2 + H2O = HCl + HClO
HClO  H+ + ClO–
H+ + ClO–
На аноде гипохлогит-ион окисляется до хлорат-иона
6ClO– + 6OH– – 6ē → 2ClO3– + 4Cl– +3/2O2 +3H2O
На катоде гипохлорит и хлорат-ионы восстанавливаются до хлорид-ионов
ClO– + 2H+ + 2ē → Cl– + H2O
ClO3– + 6H+ + 6ē → Cl– + 3H2O
На эти процессы расходуется значительная часть тока, и выход по току падает.
Аноды.
Наилучшим анодом является Pt, но она дорогая, хотя на ней максимальное перенапряжение O2 и максимальное перенапряжение Cl2. Поэтому применяется графит. Для предотвращения его разрушения выделяющимися газами, его пропаривают в льняном масле и затем обрабатывают водяным паром. За счёт полимеризации масла в порах стойкость графита возрастает.
Синтез аммиака.
В конце XIX – начале XX века аммиак получали цианамидным методом и из коксового газа.
1. Цианамидный метод открыл в 1878 году Мейер. По этому методу
CaC2 + N2 = CaCN2 + C
CaCN2 + 3H2O = CaCO3 + 2NH3
кроме того, CaCN2 – хороший гербицид
2. Из 1 тонны шихты после получения кокса можно получить до 3,% кг аммиака
Но оба эти метода не давали достаточного количества аммиака. В связи с возможностью получения HNO3 и её солей из NH3 необходимо было многотонажное производство.
В начале XX века были установлены равновесия в системе H2 – N2 – NH3 и показано, что реакция синтеза аммиака должна протекать при высоких температурах и давлении. В связи с этим было положено начало изучению методов глубокого охлаждения воздуха и получения чистого N2 и H2. В начале века был построен первый завод по производству синтетического аммиака (Германия). В России первый завод и лучший по тем временам в мире был построен в Юзовке (Донбасс).
Синтез NH3 проводится по реакции:
N2 + 3H2  2NH3 + 90 кДж
2NH3 + 90 кДж
Равновесный выход NH3 зависит от температуры и давления следующим образом.
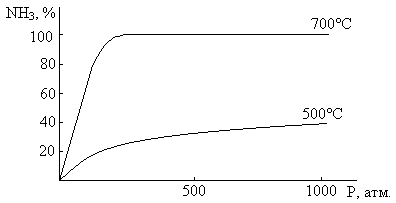
H2 : N2 = 3 : 1, но при высоких температурах скорость реакции выше
Тепловой эффект реакции также зависит от давления
ΔG = ΔH – TΔS
при ΔG = 0 (равновесие) 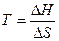
при P↑ => ΔH↑, ΔS↓ => T↑, скорость реакции увеличивается
Однако при повышении давлении равновесие реакции смещается вправо, а при повышении температуры – влево:
N2 + 3H2  2NH3 + Q
2NH3 + Q
→ P↑
T↑ ←
Из всего этого следует, что полное превращение элементов в NH3 невозможно. Поэтому процесс ведут циклически, после каждого цикла конденсацией отделяется образующийся аммиак, а газовую смесь возвращают в колонну синтеза.
Превращение H2 и N2 в NH3 проводят на катализаторе – железе, активированных K2O, Al2O3, CaO, SiO2 при 450-500°C. Срок службы катализатора высок, выход составляется половину от равновесного. Это позволяет сократить время пребывания газа над катализатором и увеличить объемную скорость газа (уменьшает количество NH3 в газе, но увеличивается производительность за счёт цикличности процесса).
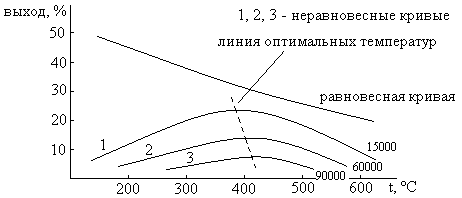
Если соединим максимумы неравновесных кривых, получим оптимальные условия.
[Vоб] = 1 м3 газа/(м3 kat • час)
Vоб = 90000 – выход 15%, Vоб = 15000 – выход 20% – максимальные выходы при 450-550°C. Но, увеличивая Vоб, увеличивают производительность процесса.
На увеличении производительности сказывается и давление
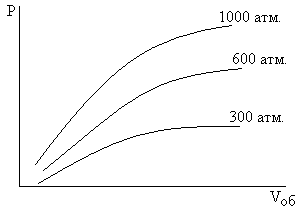
При охлаждении газовой смеси до комнатной температуры при повышенном давлении и переходе аммиака в жидкое состояние, его отделяют о повторяют процесс.
Схема синтеза NH3 в зависимости от давления делится на 3 типа:
- Синтез низкого давления, до 100 атм. – 5%
- Синтез среднего давления, до 600 атм. – 70%
- Синтез высокого давления, до 1000 атм. – 25%
Схема синтеза следующая:
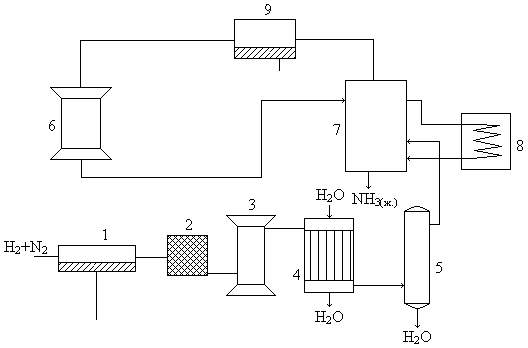
1 – компрессор, 2 – маслоотделитель, 3 – колонна предкатализа, 4 – холодильник, 5 – отделитель воды, 6 – колонна синтеза, 7 – отделитель NH3, 8 – испаритель, 9 – компрессор
В колонне предкатализа происходит очистка от каталитических ядов CO, O2. Колонна заполнена отработанным катализатором и при 450-500°C происходят реакции:
CO + H2O = CO2 + H2
O2 + 2H2 = 2H2O
CO + 3H2 = CH4 + 2H2O
CH4 + 2O2 = CO2 + 2H2O
Остатки CO2 + H2O отделяют.
В самой циркуляционной установке происходит отделение NH3 и подпитка газовой смеси H2 и N2, а компрессор (9) выравнивает давление в системе, так как по реакции давление всё время сниажется.
Дата добавления: 2015-06-17; просмотров: 4677;
