Умеренный холод.
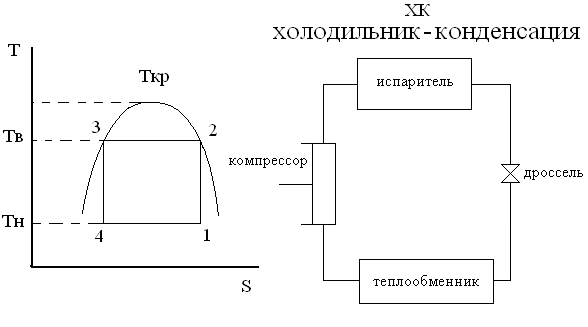
1-2 – адиабатическое сжатие рабочего тела, S=const
2-3 – изотермическая и изобарическая конденсация паров рабочего тела в конденсаторе, Тв и Рв – const
3-4 – адиабатическое расширение РТ в расширителе, S=const
4-1 – изотермическое и изобарическое испарение РТ в расширителе, Тн и Рн – const
Вместо расширения дроссельный вентиль
 ∆Ρ=Рн – Рк – гидравлическое сопротивление котла (трение потока о его стенки).
∆Ρ=Рн – Рк – гидравлическое сопротивление котла (трение потока о его стенки).
Энтальпия потока должна iн→iк, но ∆I переходят в тепло, а последняя целиком возвращается потоку, а значит iн=iк. Эффект дросселирования.
В данном случае происходит изоэнтальпийный процесс.
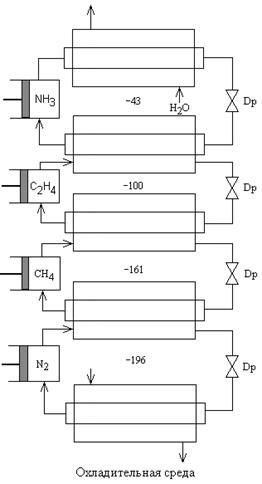
Каскадный метод
Он заключается в том, что от тел с более низкой температурой кипения отнимается тепло, передаётся телам с более высокой температурой кипения. Для этого существуют холодильные агенты, т.е. вещества, при испарении которых поддерживается определённая температура.
При каскадном методе устанавливаются последовательно компрессорные холодильные машины т.о., что испаритель каждой предыдущей холодильной машины является конденсатором последующей, создавая возможность сжижения хладорегента с более низкой критической температурой. Холодильная установка для разделения конверторного газа и сжижения воздуха состоит из четырёх циклов – аммиачного, этиленового, метанового и азотного. У этого цикла каждый последующий агент может быть сконденсирован предыдущим, но нельзя например этилен сконденсировать водой, метан – аммиаком и азот – этиленом. Причём конденсация проходит под повышенным давлением (в каждом цикле своё давление) и после дросселирования испарение с охлаждением. С помощью этого метода из газов конверсии метана, коксового газа выделяют водород или готовую азотно-водородную смесь или сжижают воздух.
Метод дросселирования.
Он основан на свойствах реальных газов и заключается в понижении температуры газа в определённых условиях при его расширении (дросселировании). Такие газы как O2, N2, H2, He не могут быть переведены в жидкое состояние при обычных температурах действием больших давлений (как например пропан) поскольку их критическая температура ниже –100°С и они сжижаются только методом дросселирования.
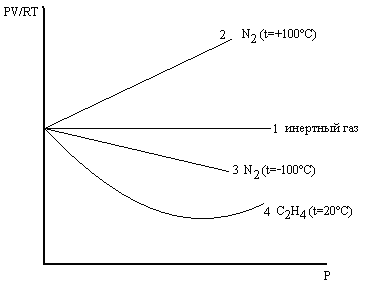
Для идеальных газов их сжимаемость не зависит от давления (прямая 1), для реальных – наоборот, причём PV  RT может быть (прямая 2, 3, 4).
RT может быть (прямая 2, 3, 4).
Для реальных газов используют уравнение Ван-дер-Ваальса:
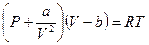
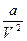 – молекулярное давление
– молекулярное давление
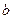 – несжимаемый объём.
– несжимаемый объём.
Дроссельный эффект заключается в том, что при расширении сжатого газа до более низкого давления без совершения внешней работы и без обмена теплотой с окружающей средой происходит изменение температуры газа.
Существуют дифференциальный и интегральный дроссельный эффекты.
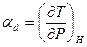 – изменение температуры газа происходит под действием бесконечно малого изменения P при постоянной энтальпии. В практике принимают δΡ = 1 атм. и, например, для воздуха αd = 0,25°.
– изменение температуры газа происходит под действием бесконечно малого изменения P при постоянной энтальпии. В практике принимают δΡ = 1 атм. и, например, для воздуха αd = 0,25°.
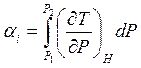 – изменение температуры газа при изменении давления P1→ P2.
– изменение температуры газа при изменении давления P1→ P2.
Для выяснения физического смысла циклов рассмотрим термодинамику дроссеоирования.
H – энтальпия – const
H=U+PV
U – удельная внутренняя энергия
PV – удельная потенциальная энергия давления
V – удельный объём
При H=const
Uн+PнVн= Uк+PкVк, из этого следует, что изменение PV приводит к изменению U, а значит и T.
Для идеального газа
Если PнVн=PкVк и Uн=Uк ∆T=0 – нет эффекта.
Если PнVн<PкVк , то Uн>Uк , то с падением давления U – падает и T падает – ПОЛОЖИТЕЛЬНЫЙ ДРОССЕЛЬНЫЙ ЭФФЕКТ, 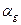 >0 – охлаждение
>0 – охлаждение
Если PнVн>PкVк , то Uн<Uк ,T ↑ , и 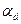 <0 – ОТРИЦАТЕЛЬНЫЙ ДРОССЕЛЬНЫЙ ЭФФЕКТ.
<0 – ОТРИЦАТЕЛЬНЫЙ ДРОССЕЛЬНЫЙ ЭФФЕКТ.
Но кроме дроссельного эффекта используется и адиабатическое расширение с отдачей внешней работы.
Первый закон термодинамики
dQ=dU+dl
dQ – тепло, dl – удельная работа, производимая рабочим телом
при адиабатическом процессе dQ=0 и dU=–dl , оттуда следует, что адиабатическое расширение с отдачей внешней работы всегда приводит к охлаждению.
Для реального газа P1V1≠P2V2 и значит U1≠U2 и дросселирование приводит к изменению температуры. Физическую сущность эффекта дросселирования можно уяснить из следующих рассуждений.
Пусть H1, H2 – энтальпии сжатого и расширенного газа. Поскольку у нас в процессе изменяются и объём, и температура, и давление, то можно записать для энтальпии следующие выражения:
H1=U1+CpT1+P1V1
H2=U2+CpT2+P2V2
Где Ui – внутренняя потенциальная энергия газа (работа, затраченная на удаление молекул друг от друга), PiVi – работа перемещения газа, CpTi – кинетическая энергия движения молекул при dH=0, т.е. H1=H2. Для P,T= const H=U+PT.
U1+CpT1+P1V1= U2+CpT2+P2V2
отсюда Cp(T1–T2) = (U2–U1) – (P1V1–P2V2)
(P1V1–P2V2) является мерой работы, совершённой газом при дросселировании. Она может быть >0,<0,=0.
Рассмотрим 3 случая:
1. dU>0, то U2>U1
А) P1V1< P2V2, ∆<0 ПН>0 => ЛН>0 T1>T2
Большой положительный дроссельный эффект, газ охлаждается.
Б) P1V1= P2V2, ∆=0 ПН>0 => ЛН>0 T1>T2
Меньший дроссельный эффект.
В) P1V1> P2V2, ∆>0 dU >∆ ПН>0 => ЛН>0 T1>T2
Очень малый дроссельный эффект.
2. P1V1> P2V2, dU = (P1V1–P2V2)
ПН=0 ЛН=0 dT=0 T1=T2
дроссельный эффект=0.
3. P1V1> P2V2, dU < (P1V1–P2V2)
ПН<0 ЛН<0 T1<T2
Отрицательный дроссельный эффект.
Дата добавления: 2015-06-17; просмотров: 1738;
