Конверсия метана с целью получения водорода.
Метод конверсии состоит в окислении метана водяным паром или кислородом по следующим основным реакциям:
CH4 + H2O  CO + 3H2 – Q (1)
CO + 3H2 – Q (1)
CH4 + CO2  2CO + 2H2 – Q (2)
2CO + 2H2 – Q (2)
CH4 + ½O2  CO + 2H2 + Q (3)
CO + 2H2 + Q (3)
CH4 + 2O2  CO2 + 2H2O + Q (4)
CO2 + 2H2O + Q (4)
CO + H2O  CO2 + H2 + Q (5)
CO2 + H2 + Q (5)
Выбор окислителей определяется экономичностью процесса. Полное превращение метана практически достигается при температуре выше 1200°C. В избытке водяного пара протекает следующая реакция:
CH4 + 2H2O  CO2 + 4H2 – 165 кДж (6)
CO2 + 4H2 – 165 кДж (6)
При низких температурах реакция (1) смещается влево, а (5) – вправо. Значит, в конечной газовой фазе будет находиться большое количество CH4. При высоких температурах наоборот – большое количество CO. Отсюда одноступенчатый процесс (6) невыгоден, и процесс проводят в 2 стадии: (1) + (5).
I стадия – окисление CH4.
Эта стадия может протекать гомогенно и гетерогенно (в присутствии катализатора). Механизм гомогенной конверсии метана может заключаться во взаимодействии пара как с метаном, так и с продуктами его разложения.
CH4 → C2H6 → C2H4 → C2H2 → C с получением в газовой фазе H2, CO и CO2
В присутствии кислорода
CH4 → CH2O → CO → CO2
Эти реакции протекают при t > 1000°C.
В условиях гетерогенно-каталитического процесса значительно снижается температура процесса. В этом случае механизм следующий:
CH4  C + 2H2
C + 2H2
C + H2O  CO + H2
CO + H2
––––––––––––––––––––––––––
CH4 + H2O  CO + 3H2
CO + 3H2
Лучшими катализаторами для реакции конверсии является никелевый катализатор, нанесённый на оксид алюминия и промотированный MgO и Cr2O3. Однако этот катализатор чувствителен к соединениям серы. Расход пара в присутствии катализатора происходит по стехиометрии, и не происходит выделение углерода.
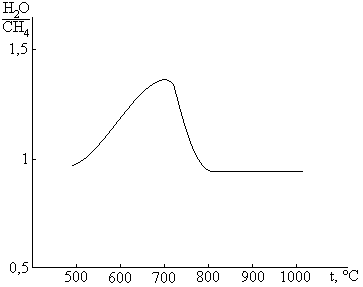
II стадия – окисление окиси углерода.
Реакция (5) – равновесная и с увеличением температуры смещается влево. Однако, увеличивая концентрацию водяного пара, смещают реакцию вправо. Зависимость % выхода H2 от соотношения H2O/CO доказывает это
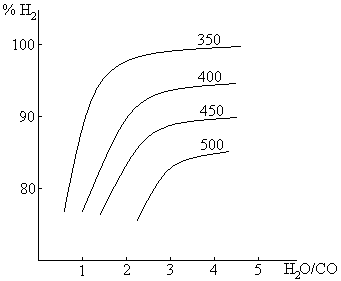
Эта реакция не зависит от давления, и этот метод увеличения скорости реакции здесь неприменим. Более того, реакция (5) протекает с выделением тепла, и проведение реакции в 1 ступени приводит к повышению температуры и смещению равновесия влево. Поэтому реакцию проводят в несколько ступеней, при которых происходит следующая последовательность: пропускание реакционной смеси над катализатором – охлаждение для смещения равновесия вправо и закаливания смеси, и цикл повторяют.
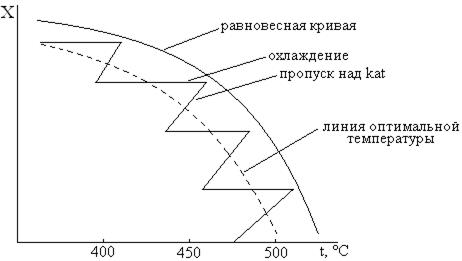
На данной стадии для быстрого установления равновесия смесь пропускают над катализатором.
Железохромовый катализатор, промотированный оксидами Al, K, Ca, обеспечивает достаточную степень конверсии CO при 450-500°C – 96-98%. Цинк-хром-медный катализатор обеспечивает конверсию остаточного содержимого CO 0,2-0,4%, работает при 200-300°C, но очень чувствителен к ядам.
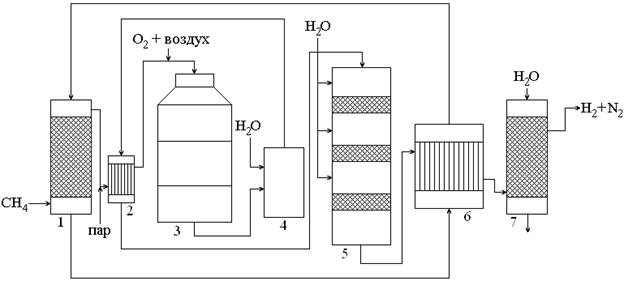
Схема процесса конверсии метана следующая
1. Природный газ с содержанием CH4 – 97% поступает в сатуратор (1), где нагревается до 80°C и насыщается водяным паром, затем поступает в теплообменник (2).
2. В теплообменнике (2) газ нагревается до 500°C отходящими конверторными газами, смешивается с кислородом или воздухом и подаётся в конвертор (3).
3. В конверторе (3) сначала идут экзотермические реакции:
CH4 + ½O2  CO + 2H2 + Q
CO + 2H2 + Q
CH4 + 2O2  CO2 + 2H2O + Q
CO2 + 2H2O + Q
и температура повышается до 1000°C. Затем протекают эндотермические реакции:
CH4 + H2O  CO + 3H2 – Q
CO + 3H2 – Q
CH4 + CO2  2CO + 2H2 – Q
2CO + 2H2 – Q
Конвертированный газ содержит H2 – 51-54%, N2 (если подавали воздух) – 20%, CO – 20%, CO2 – 7%, CH4 – 0,5%.
4. Затем газ увлажняется в увлажнителе (4), охлаждается до 400-500°C в теплообменнике (2) и поступает в конвертор CO (5).
5. В конверторе CO (5) газ проходит ряд тарелок с катализатором, охлаждаясь между ними конденсатом.
6. Далее проходит через теплообменник (6).
7. И в промывной башне (7) очищается от твёрдой части и от CO, CO2, O2 методом последовательной конденсации.
В итоге получается либо чистый водород в случае использования для конверсии метана чистого кислорода, либо азото-водородная смесь, если используют в качестве окислителя воздух.
Дата добавления: 2015-06-17; просмотров: 8605;
