Поняття про структурний, термодинамічний та кінетичний фактори контролю розподілу елементів в геологічних об’єктах.
Коф.росподілу-відношення концентрац. Ел.в продуктах реакції (процесу) до концентрац. Ел. В реагентах (вихідній речов.) К>накопич.,когерентність,сумісність, К<вимушене захоплення
К= 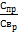 Комбінований коф.розподілу
Комбінований коф.розподілу 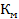 =а
=а 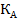 +B
+B 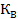 +ϒ
+ϒ 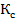
Структурний контроль. Можливість входження залежить від природи зв’язку ,розмірів ,зарядів йонів,геометричної форми комірок.
Правила розподілу іонів між рідкою і твердою фазою
1.Іони з близькими радіусами і тотожніми зарядами переходять в тверду фазу в к-стях пропорц.їх концентрац. В розч.
2.З двох іонів з однаковими зарядми до складу кристалу в першу чергу входитиме іон меншого радіусу
3.З двох іонів з однаковими радіус.до складу кристалу в першу чергу переходить іон з більшим зарядом.
Термодинамічний контроль. Вплив на мінералоутв. Р.Т.умов ,концентрація,фазовий склад.
Дозволяє визначити вірогідність процесу .Не розглядє конкретних шляхів реалізації процесів ,не дає відповіді ,чому процеси ідуть так чи інакше.
Фіз.хім систем-сукупність взаємодіючих компонентів,виділ в навкол. Середов
Прості системи-ті,стан,яких визначається тепловими,механік., хім. Взаємодіями,а сили поверхневого натягу ,гравіт. сил.
Начала термодинаміки
1.Визначення больцмана:природа в своїх процесах спрямована від менш вірогідних станів до більш вірогідних
2наслідки постулатів нериста і планка
Нериста:при зниженні Тенергія наближу до до певного визначеного значення. Планка:при зниженні Т до абсолютного 0 ентропія всіх речовин стає однаковою і дорівн 0. Ентропія всіх тіл при пониж Т зменш. І приймає однакову для всіх речовин нульову величину при Т абсолютнт.нуля
Постулат Капусницького: ентропія всіх речовин при зростанні Р і іх ущільнені значення зменш.
Кінематичний контроль. Кінетика реакцій Реакції:сумарні,елементрн H2O-H+ +OH- CO2+H2O-H2CO3 Cума елементарної реакції – механізм сумарної реакції.
Дата добавления: 2015-04-07; просмотров: 987;
