Периодическая система химических элементов и закономерности изменения атомных характеристик элементов.
 Основой периодического закона Д.И. Менделеева является принцип Паули, который ограничивает электронную емкость АО двумя электронами с различными спинами, что определяет закономерное ограничение числа электронов на квантовых подуровнях и уровнях в многоэлектронных атомах и, как следствие этого, возникновение периодического подобия в электронном строении внешних (валентных) электронных оболочек атомов и свойствах химических элементов с ростом заряда ядра и числа электронов.
Основой периодического закона Д.И. Менделеева является принцип Паули, который ограничивает электронную емкость АО двумя электронами с различными спинами, что определяет закономерное ограничение числа электронов на квантовых подуровнях и уровнях в многоэлектронных атомах и, как следствие этого, возникновение периодического подобия в электронном строении внешних (валентных) электронных оболочек атомов и свойствах химических элементов с ростом заряда ядра и числа электронов.
Периодическая система – форма математического отражения периодического закона, показывающая, что качественно отличные друг от друга химические элементы в совокупности образуют упорядоченное множество, подчиненное внутренней взаимосвязи между собой.
Периодические таблицы – различные формы графического отображения периодической системы на плоскости.
Номер периода – горизонтального ряда химических элементов в периодической таблице – определяется значением главного квантового числа n внешнего уровня, а число элементов в периоде – суммарной электронной емкостью заселяемых электронами подуровней.
Горизонтальное распределение элементов по периодам определяет формирование в периодических таблицах вертикальных столбцов элементов с подобным числом (от 1 до 8) электронов на внешних орбиталях – восьми групп химических элементов. Элементы каждой группы подразделяются на две подгруппы – главную (подгруппа А), состоящую из непереходных элементов с валентными электронами на s- и р-орбиталях, и побочную (подгруппа В), включающую непереходные c валентными электронами на d- и f-орбиталях. Элементы каждой подгруппы, характеризующиеся подобным характером распределения валентных электронов по АО, называются электронными аналогами и могут быть описаны общей электронной формулой.
Пример 1. Почему хлор и марганец расположены в одной группе, но разных подгруппах? Какие элементы VII группы являются электронными аналогами?
Решение. Электронные конфигурации атомов: Cl [Ne]3s23p5, Mn [Ar]3d54s2 отвечают наличию 7 валентных электронов, что определяет положение этих элементов в VII группе. Однако различный характер валентных орбиталей непереходного элемента хлора и переходного элемента марганца определяет положение этих элементов в главной и побочной подгруппах.
Электронными аналогами VII группы являются - галогены F, Cl, Br, I, At с общей электронной формулой ns2np5 и элементы семейства марганца Mn, Tc, Re c общей электронной формулой (n-1)d5ns2, где n – главное квантовое число внешнего уровня, соответствующее номеру периода.
Пример 2. Классифицируйте следующие химические элементы в зависимости от электронного строения и положения в периодической системе: S, Sr, Os, Ti, Pr, Cf.
Решение. Значение главного квантового числа и число электронов на валентных орбиталях S 3s23p4 показывает, что S расположена в 3 периоде, VIА группе периодической системы и относится – к поздним, непереходным, типическим, р-элементам, входящими в состав халькогенов.
Стронций Sr 5s2 - элемент 5 периода, IIА группы относится к ранним, непереходным, s-элементам, подсемейства кальция, входящими в состав щелочноземельных металлов.
Осмий Os 5d66s2 – элемент 6 периода, VIIIВ группы относится к поздним, тяжелым, переходным, 5d-элементам,входящими в состав – 5d-элементов 3 декады, 3 переходного ряда, семейства платиновых металлов.
Титан Ti 3d24s2 – элемент 4 периода, IVВ группы относится к ранним, легким, переходным, 3d-элементам, входящими в состав – 3d-элементов 1 декады, 1 переходного ряда, семейства титана.
Празеодим Pr 4f36s2 – элемент 6 периода, IIIB группы относится к ранним, переходным, 4f-элементам, входящими в состав – лантаноидов, семейства церия.
Калифорний Cf 5f107s2 – элемент 7 периода, IIIB группы относится к поздним, переходным, 5f-элементам, входящими в состав – актиноидов, семейства берклия, а также трансурановых элементов.
Периодическое изменение электронного строения атомов химических элементов приводит к периодическому изменению их атомных характеристик с ростом заряда ядра – атомных и ионных радиусов, энергии (потенциала) ионизации и сродства к электрону, относительной электроотрицательности. По периоду заселение электронами одного и того же квантового уровня приводит с ростом заряда ядра к общему уменьшению радиусов атомов и увеличению энергии ионизации, энергии сродства к электрону и относительной электроотрицательности химических элементов. Увеличение же главного квантового числа валентных орбиталей определяет общее увеличение радиусов атомов и уменьшение энергии ионизации, энергии сродства к электрону и относительной электроотрицательности химических элементов группы. В тоже время, повышенная устойчивость наполовину и целиком заполненных электронами валентных орбиталей подуровней определяет немонотонный – внутрипериодический характер изменения атомных характеристик элементов по периоду, а различие в электронном строение внутренних электронных слоев для элементов одной подгруппы, но разных периодов приводит к немонотонному изменению эффективного заряда ядра атомов и, как следствие этого, к вторичнопериодическому характеру изменения атомных характеристик элементов по группе.
Пример 3. Какой атом или ион в каждой из следующих пар: а) О, О2-; б) О, S; в) О, F; г) Fe, Fe3+; д) K, Cu; е) Au, Ag; ж) S2-, Ca2+ характеризуются большим радиусом и почему?
Решение. a) r(O2- [He]2s22p6) > r(O [He]2s22p4) – увеличение эффективного заряда ядра атома О по сравнению с ионом О2- в связи с уменьшением числа электронов при постоянном заряде ядра;
б) r(S [[Ne]3s23p4) > r(O [He]2s22p4) – увеличение главного квантового числа валентных орбиталей для электронных аналогов;
в) r(O [He]2s22p4) > r(F [He]2s22p5) – увеличение эффективного заряда ядра атома F по сравнению с О в связи с увеличением заряда ядра и заселением электронами одного квантового уровня;
г) r(Fe3+ [Ar]3d3) > r(Fe [Ar]3d64s2) – увеличение эффективного заряда ядра иона Fe3+ по сравнению с Fe в связи с уменьшением числа электронов при постоянном заряде ядра;
д) r(K [Ar]4s1) > r(Cu [Ar]3d104s1) – заселение электронами внутренних 3d-орбиталей приводит к «d-сжатию» для атома меди;
е) r(Ag [Kr]4d105s1) ~ r(Au [Xe]4f145d106s1] – заселение электронами внутренних 4f-орбиталей приводит к «f-сжатию» для атома золота;
ж) r(S2- [Ar]) > r(Ca2+ [Ar]) – увеличение заряда ядра иона S2- по сравнению с изоэлектронным ионом Ca2+.
Пример 4. Определите величину ковалентного радиуса атомов Cl и I, а также оценку длины химической связи в молекуле ICl, если межъядерные расстояния в молекулах I2 2.67 Å и Cl2 1.99 Å.
Решение. Величина ковалентного радиуса атома химического элемента соответствует половине межъядерного расстояния между атомами, связанными одинарной химической связью в молекулах простых веществ:
r(Cl) = d(Cl2)/2 = 0.995 Å, r(I) = d(I2)/2 = 1.335 Å.
Длина связи в молекуле ICl может быть оценена как сумма ковалентных радиусов компонентов:
d(ICl) = r(I) + r(Cl) = 1.335 + 0.995 = 2.35 Å.
Пример 5. Константа кристаллической решетки KCl равна 3.16 Å. Рассчитайте эффективный радиус иона К+, если радиус иона Cl- составляет 1.81 Å.
Решение. Константа кристаллической решетки определяется расстоянием между центрами двух соседних структурных единиц. Для KCl c ионной кристаллической решеткой ионов константа кристаллической решетки (К) определяется суммой ионных радиусов r(K+) и r(Cl-):
K = r(K+) и r(Cl-),
r(K+) = K – r(Cl-) = 3.16 – 1.81 = 1.35 Å.
Пример 5. Как и почему изменяется величина энергии ионизации для атомов следующих химических элементов: а) Li, Be, B; C, N, O, F, Ne; б) Zn, Cd, Hg?
Решение. а) Li < Be > B < C < N > O < F << Ne – в целом по периоду с ростом радиуса атом величина потенциала ионизации уменьшается. Немонотонный характер изменения потенциалов ионизации по периоду, связанный с повышенными значениями потенциалов ионизации атомов Be 2s2, N 2s22p3 и Ne 2s22p6 отражает явление внутренней периодичности в связи с повышенной устойчивостью наполовину и полностью заполненных электронами подуровней;
б) Cu [Ar]3d104s1 > Ag [Kr]4d105s1 < Au [Xe]4f145d106s1 – от Cu к Ag происходит увеличение радиуса и уменьшение потенциала ионизации. Появление у Au заполненной электронами внутренней 4f-оболочки приводит как эффекту f-сжатия в результате чего радиусы атомов Au и Ag близки, так и к росту эффективного заряда ядра Au по сравнению с Ag в результате проникновения 6s-электрона под двойной экран 4f145d10 внутренних подуровней.
Пример 6. Как и почему изменяется энергия сродства к электрону в ряду следующих элементов: а) F, Cl, Br; б) C, N, O?
Решение. а) F < Cl > Br – в целом по группе с ростом радиуса атомов энергия сродства к электрону уменьшается.Пониженное значение энергии сродства к электрону для атома F связано с проявлением эффекта межэлектронного отталкивания в результатеаномально низкого значения радиуса атома;
б) С > N < O – в целом по периоду с уменьшением радиуса атомов энергия сродства к электрону увеличивается. Пониженное значение энергии сродства к электрону для атома N связано с повышенной устойчивостью наполовину заполненного 2p3-подуровня атома азота.
Пример 7. На основании положения элементов в периодической системе расположите следующие элементы в ряд по величине относительной электроотрицательности: а) O, P, S; б) Mg, Al, Si; в) S, Cl, Br; г) C, Si, N.
Решение. В соответствии с общим увеличением относительной электроотрицательности элементов по периоду и уменьшением по группе: а) O [He]2s22p4 > S [Ne]3s23p4 > P [Ne]3s23p3;
б) Mg [Ne]3s2 > Al [Ne]3s23p1 > Si [Ne]3s23p2;
в) Cl [Ne]3s23p5 > Br [Ne]4s24p5 > S [Ne]3s23p4;
г) N [He]2s22p3 > C [He]2s22p4 > Si [Ne]3s23p4.
Пример 8. Потенциал ионизации (I) и энергия сродства брома к электрону (Ae) составляют: I = 1140.8 кДж/моль, Ае = 3.54 Эв/атом. Вычислите по шкале Малликена величину относительной электроотрицательности брома, если электроотрицательность лития равна 268 кДж/моль.
Решение. По шкале Малликена электроотрицательность (ЭО) атома химического элемента определяется полусуммой величин потенциала ионизации (I) и энергии сродства к электрону (Ae): ЭО = ½(I + Ae).
Так как 1эВ = 1.602×10-22 кДж, то энергия сродства брома к электрону в кДж/моль равна:
Ае = 3.54×1.602×10-22×6.02×1023 = 341.4 кДж/моль,
а электроотрицательность брома составляет:
ЭО = ½(1140.8 + 341.4) = 741.1 кДж/моль.
Поскольку за единицу электроотрицательности в шкале Малликена принята электроотрицательность Li (ЭО = 268 кДж/моль), то величина относительной электроотрицательности (ОЭО) брома равна:
ОЭО(Br) = ЭО(Br)/ЭО(Li) = 741.1/268 = 2.8.
 Упражнения:
Упражнения:
49. Охарактеризуйте следующие химические элементы с точки зрения их классификации в зависимости от электронного строения и положения в периодической системе: Ag, V, Rb, Po, Cl, Mg, Dy, Fm.
50. Почему сера и хром расположены в одной группе, но разных подгруппах? Какие элементы VI группы являются электронными аналогами?
51. Какие виды дополнительной периодичности наблюдаются в характере изменения атомных характеристик химических элементов по периоду и группе? В чем их причина?
52. Какой атом или ион в каждой из следующих пар: а) S, S2-; б) N, P; в) N, О; г) Co, Co2+; д) Rb, Ag; е) Cd, Hg; ж) Se2-, Sr2+ характеризуются большим радиусом и почему?
53. Определите величину ковалентного радиуса атомов брома и водорода, а также оценку длины химической связи в молекуле бромоводорода, если межъядерные расстояния в молекулах Br2 2.28 Å и H2 0.60 Å.
54. Получите оценки длины химических связей H-O в H2O и H-N в NH3, если межъядерные расстояния в молекулах H2, O2 и N2 составляют: 0.74 Å, 1.20 Å и 1.09 Å соответственно.
55. Рассчитайте радиус иона Na+ в кристалле NaF, если константа решетки NaF составляет 2.31 Å и радиус иона F- равен 1.33 Å.
56. Константа кристаллической решетки KBr равна 3.29 Å. Определите величину ионного радиуса Br-, если радиус иона K+ составляет 1.33 Å.
57. Энергии ионизации (I) атомов благородных газов составляют (в эВ): He 24.6, Ne 21.6, Ar 15.8, Kr 14.0, Xe 12.1, Rn 10.8. Постройте и объясните графическую зависимость величины I от номера периода.
58. Значения первых потенциалов ионизации для элементов II группы соответственно равны (в эВ): Be 9.32, Mg 7.64, Ca 6.11, Sr 5.69, Ba 5.21, Ra 5.28; Zn 9.39, Cd 8.99, Hg 10.43. Построить и объяснить графические зависимости величины потенциала ионизации от номера периода для элементов главной и побочной подгруппы.
59. Объяснить характер изменения последовательных потенциалов ионизации для атома углерода (в эВ): I1 11.3, I2 24.4, I3 47.9, I4 64.5, I5 392.
60. Относительная электроотрицательность иода по шкале Малликена составляет 2.5, а его потенциал ионизации 10.45 эВ. Определите энергию сродства иода к электрону (кДж/моль), если относительная электроотрицательность лития по шкале Малликена равна 1 и электроотрицательность равна 278 кДж/моль.
61. Определить относительную электроотрицательность углерода по шкале Малликена, если потенциал ионизации и энергия сродства к электрону для углерода соответственно равны: 11.26 и 1.12 эВ. Относительная электроотрицательность лития по шкале Малликена равна 1, а его электроотрицательность 278 кДж/моль.

Индивидуальные задания по теме
“Строение атома, периодический закон”
Вариант 1.
1. Опишите опыты, в результате которых были открыты катодные лучи и изучены их свойства.
2. Для ряда металлов работа выхода фотоэлектрона составляет:
| Металл | Сa | Cd | Cr | Fe | Mg |
| W×10-19, Дж | 4,69 | 6,75 | 7,20 | 7,70 | 5,56 |
Определить пороговую длину волны электромагнитного излучения – красную границу фотоэффекта для каждого из этих металлов. Для каких из металлов будет наблюдаться фотоэффект при облучении их: а) зеленым (l = 500 нм), б) синим (l = 400 нм) видимым светом?
3. Если бы электрон в атоме мог характеризоваться тремя значениями спинового квантового числа ms = +1/2, 0, -1/2, а все остальные квантовые числа имели бы прежние разрешенные значения, сколько неспаренных электронов должно было бы быть в атоме углерода? Какую электронную конфигурацию имел бы атом углерода в основном состоянии в таком случае?
4. Используя сокращенные электронные формулы, записать переходы: P3-®P ®P+®P3+®P5+, V®V+®V2+®V3+®V5+. Записать электронно-графические формулы: P, P+, V, V+.
5. Приведите примеры и обоснуйте диагональное сходство свойств химических элементов.
Вариант 2.
1. Опишите опыты, в результате которых были установлены масса и заряд электрона. Сопоставьте массу электрона с массой атома H.
2. Определить массу и энергию фотона (в джоулях, электрон-вольтах и джоулях на моль), соответствующую появлению в спектре атомарного H наиболее длинноволновой серии Лаймена. Какова длина волны и частота фотонов?
3. Используя описание корпускулярно-волновых свойств электромагнитного излучения на основе представлений с одной стороны о потоке фотонов с определенной энергией и импульсом, а с другой – электромагнитной волны с определенной амплитудой и длиной волны, обоснуйте, почему вероятность нахождения электрона в данном объеме пространства может быть охарактеризована квадратом его волновой функции.
4. Напишите сокращенные электронные и электронно-графические формулы атомов элементов четвертого периода – K, Sc, Mn, Cu, As и Kr. Классифицируйте эти элементы с точки зрения их электронного строения и положения в периодической системе.
5. Дайте определение энергии (потенциала) ионизации атома. Как и почему изменяется величина энергии ионизации в ряду элементов I группы главной и побочной подгруппы?
Вариант 3.
1. Опишите опыты, в результате которых было открыто явление радиоактивности и приведите характеристики трех типов радиоактивного распада - a, b и g.
2. Вычислите радиус, скорость движения и длину волны электрона на третьей боровской орбите. Как изменятся эти величины для иона Li2+?
3. Начиная с какого значения главного квантового числа n возможно появление у атома g-подуровня? Сколько атомных орбиталей и электронов может содержать g-подуровень? Известен ли какой-нибудь элемент, электронная конфигурация которого в основном состоянии включает наличие электронов на g-подуровне? Известны ли химические элементы, электронная конфигурация которых в возбужденном состоянии включает наличие электрона на g-подуровне? Определите энергию перехода между основным состоянием атома водорода и его возбужденным 4g-состоянием.
4. Какая из следующих электронных конфигураций и почему соответствует основному и возбужденному состоянию: 1) Cr 3d54s1 и Cr 3d44s2; 2) V+ 3d4 и V+ 3d44s1; 3) P+ 3p34s1 и P+ 3p4.
5. Дайте определение энергии сродства к электрону. Почему экспериментальные значения энергии сродства к электрону известны для ограниченного числа элементов периодической системы. Как и почему изменяется величина энергии сродства к электрону для р-элементов 7 группы.
Вариант 4.
1. Опишите опыты, в результате которых была предложена планетарная модель строения атома Резерфорда. Почему аналогичные опыты по рассеиванию b-излучения, проведенные Ленардом, «подтверждали» модель строения атомов Томсона? Какие проблемы планетарной модели строения атома указывали на необходимость ее дальнейшей модификации?
2. Поток нейтронов движется со скоростью 3.78×103 м/c. Рассчитайте – кинетическую энергию, импульс и длину волны нейтрона. Обоснуйте - можно ли экспериментально наблюдать дифракцию такого потока нейтронов.
3. Какой из принципов природы ограничивает электронную емкость атомных орбиталей, подуровней и уровней в атомах? Какие правила определяют энергетическую последовательность заселения электронами атомных орбиталей в многоэлектронных атомах? Какие из состояний р-элементов VI-группы, описываемых схемами:
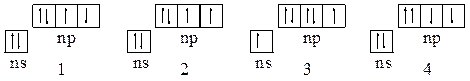 |
и почему соответствуют состоянию атомов в основном состоянии, в возбужденном состоянии и принципиально невозможны?
4. Напишите сокращенные электронные и электронно-графические формулы атомов элементов пятого периода – Rb, Y, Mo, Pd, Sn и Te. Классифицируйте эти элементы с точки зрения их электронного строения и положения в периодической системе.
5. Дайте определение понятия относительной электроотрицательности химического элемента. На чем основаны шкалы относительной электроотрицательности элементов по Поллингу, по Малликену, по Ольреду-Рохову. На примере элементов 3 периода и р-элементов VII группы проанализируйте характер изменения величины относительной электроотрицательности по периоду и по группе.
Вариант 5.
1. Опишите опыты, указывающие на корпускулярно-волновые свойства электромагнитного излучения. Какие экспериментальные данные явления фотоэффекта не могут быть описаны в рамках волновой природы электромагнитного излучения? В чем уникальность фотона по сравнению с другими материальными частицами?
2. Зная, что дина волны рентгеновского Кa излучения Fe равна 1.931Å,определить порядковый номер элемента с длиной волны Кa рентгеновского излучения 3,35 Å. Какой это элемент, cколько протонов содержит ядро атомов этого элемента и какова относительная атомная масса его наиболее распространенного в природе изотопа?
3. Почему в отличие от атома водорода и водородоподобных ионов для описания электронного строения могоэлектронных систем используют приближенные методы нахождения их волновых функций? На чем основан метод самосогласованного поля?
4. Напишите сокращенные электронные и электронно-графические формулы атомов элементов шестого периода – Ba, La, Eu, Re, Pt, Bi и Rn. Классифицируйте эти элементы с точки зрения их электронного строения и положения в периодической системе.
5. Почему существует несколько типов радиусов атомов и ионов химических элементов? Какие типы радиусов атомов и ионов распространены в химической практике? Как и почему изменяется величина радиуса атомов химических элементов первой группы главной и побочной подгруппы?
Вариант 6.
1. Опишите опыты, указывающие на дискретный характер процессов поглощения и испускания атомами энергии. Что такое спектральные серии Лаймена, Бальмера, Пашена, Бреккета, Пфунда, в каких областях электромагнитного спектра они были получены? В чем заключается соотношение Ридберга? С чем связано использование различных букв латинского алфавита (S, P, D, F) для обозначения спектральных линий?
2. Для ряда металлов работа выхода фотоэлектрона составляет:
| Металл | K | Na | Ag | Ba | Co |
| W×10-19, Дж | 3,68 | 3,84 | 7,42 | 4,32 | 8,00 |
Определить пороговую длину волны электромагнитного излучения – красную границу фотоэффекта для каждого из этих металлов. Для каких из металлов будет наблюдаться фотоэффект при облучении их: а) зеленым (l = 500 нм), б) синим (l = 400 нм) видимым светом?
3. На чем основан метод Слейтера для нахождения волновой функции многоэлектронных систем? Что такое эффективный заряд ядра (Zэфф.), константа экранирования, одноэлектронная орбиталь, одноэлектронная спин-орбиталь? От каких квантовых чисел зависит – величина Zэфф., угловая и радиальная составляющая одноэлектронных волновых функций многоэлектронных систем. Чему равна кратность вырождения атомных орбиталей третьего квантового уровня – для атома водорода и атома лития?
4. Что такое функция радиального распределения электронной плотности, узловая точка, узловая поверхность. Определите число максимумов и узловых точек функции радиального распределения электронной плотности для валентных электронов следующих атомов в основном состоянии: H, С, V, Ce. На каком расстоянии от ядра наиболее вероятно нахождение электрона для атома водорода в основном и первом возбужденном состоянии?
5. Что такое координационное число химического элемента в соединении и от каких факторов зависит его величина. На примере оксо- и фторидных комплексов р-элементов IV-VII групп в высшей степени окисления рассмотрите характер изменения координационного числа элемента в зависимости от номера периода.
Вариант 7.
1. Сформулируйте постулаты Бора и выведите теоретическое обоснование постоянной Ридберга. Как может быть интерпретирован боровский постулат об условии стационарности орбит: mvr = nh/2p с учетом волновых свойств электрона. С каким принципом природы приходит в противоречие модель электронного строения атомов Бора?
2. Рассчитайте энергию возбуждения электрона в атоме водорода при переходе с 1s- на 2р-орбиталь, если длина волны излучаемого кванта света при обратном переходе составляет 121.6 нм.
3. Определите четвертый потенциал ионизации атома бериллия и сопоставьте его значение с третьим потенциалом атома лития, вторым потенциалом атома гелия и потенциалом ионизации атома водорода.
4. Что значит решить уравнение Шреденгера? Определите понятия – стационарное состояние системы, вырожденные состояния, кратность вырождения, основное состояние, возбужденные состояния. Приведите сокращенные электронно-графические формулы соответствующие основному и одному из возбужденных состояний следующих атомов: Na, S, Mo, Ce и определите кратность вырождения валентных орбиталей данных атомов.
5. Дайте определение энергии сродства к электрону. Почему экспериментальные значения энергии сродства к электрону известны для ограниченного числа элементов периодической системы. На примере элементов второго и третьего периодов продемонстрируйте и обоснуйте периодический и внутрипериодический характер изменения величины энергии сродства к электрону с ростом заряда ядра.
Вариант 8.
1. Опишите опыты, в результате которых получено экспериментальное подтверждение гипотезы де-Бройля о корпускально-волновых свойствах электрона. Для каких еще “частиц” экспериментально обнаружено проявление волновых свойств? Что определяет возможность экспериментального наблюдения волновых свойств “частиц”? Если бы постоянная Планка имела значение 1 Дж/c, то, как бы это сказалось на движении автомобиля?
2. Используя имеющиеся в таблице данные, заполните ее полностью:
| Элемент | Число протонов | Число электронов | Суммарный заряд | Катион, анион, нейтральный атом |
| +2 | ||||
| Ca | ||||
| -1 | ||||
| +3 | ||||
| Zn | -2 | |||
| +1 |
3. Сравните понятия – атомная орбита и атомная орбиталь, используемые в боровской и вероятностной модели для описания движения электрона в атоме. На каком расстоянии от ядра наиболее вероятно нахождение электрона в основном 1s состоянии и возбужденных - 2s, 3s и 4s состояниях атома водорода?
4. Атомам каких элементов и в каком состоянии - основном, возбужденном - соответствуют следующие электронные конфигурации:
1) 1s22s2; 2) 1s23s1; 3) [Ne]3s23d1; 4) [Ar]3d24s2; 5) 1s22s22p63p1;
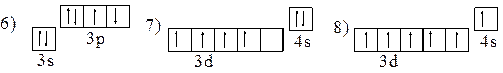 |
5. Используя данные о значении первых трех потенциалов ионизации для скандия (646, 1235, 2375 кДж/моль) и галлия (576, 1971, 2950 кДж/моль), объясните, почему значение первого потенциала ионизации для галлия несколько меньше, чем для скандия, а значения второго и третьего потенциалов ионизации галлия значительно больше, чем для скандия?
Вариант 9.
1. Сформулируйте принцип неопределенности Гейзенберга и опишите мысленный эксперимент, демонстрирующий принципиальную невозможность одновременного сколь угодно точного определения координат и импульса материального объекта. Какой подход к описанию движения микрообъектов следует из принципа неопределенности Гейзенберга. Что такое статистический метод описания движения микрообъектов?
2. Зная, что длина волны рентгеновского Кa излучения Ni равна 2.13Å,определить порядковый номер элемента с длиной волны Кa рентгеновского излучения 1.775 Å. Какой это элемент, cколько протонов содержит ядро атомов этого элемента и какова относительная атомная масса его наиболее распространенного в природе изотопа?
3. Какие характеристики атомных орбиталей и какие физические параметры движения электрона в атоме водорода определяют квантовые числа n, l и m? Чем отличаются атомные орбитали и физические параметры движения электрона в следующих состояниях: а) 2s и 3s; б) 4s, 4p, 4d и 4f; в) 4dxy и 4dx2-y2?
4. На чем основано объединение элементов в одной группе, подгруппе? Что определяет № группы и в чем проявляется специфика поздних d-элементов VIIIB, IB и IIB подгрупп? С чем связана “трудность" группового отнесения элементов первого периода? Какие элементы группы являются “электронными аналогами”? Приведите классификацию элементов III группы по их электронному строению.
5. Атомы каких элементов имеют электронные конфигурации: а) [He]2s2; б) [He]2s22p4; в) [Ar]3d24s2; г) [Ne]3s23p5; д) [Kr]4d105s25p1; е) [Kr]4d55s2; ж) [Xe]4f135s2? Классифицируйте элементы с точки зрения их электронного строения и положения в периодической системе.
Вариант 10.
1. Обоснуйте утверждение, что волновое уравнение Шреденгера для описания движения электрона основано на аналогии с описанием электромагнитного излучения, также обладающего корпускулярно-волновыми свойствами. Каким условиям должна удовлетворять волновая функция электрона? Что такое «электронная плотность»? Как на основании волновой функции определить средние физические параметры состояния электрона – его энергию, абсолютную величину и направление вектора момента количества движения, вероятность нахождения в определенной области пространства вокруг ядра?
2. Какую длину волны имеет свет, испускаемый при переходе электрона в атоме водорода из состояния с n =5 в состояние: а) c n =2, б) с n = 1. К каким спектральным сериям принадлежат эти линии?
3. Какова длина волны, соответствующая частице с массой 0.1 г, движущейся со скоростью 10 м/c? Можно ли экспериментально наблюдать волновые свойства этой частицы? Какой должна была бы быть величина постоянной Планка для экспериментального наблюдения волновых свойств этой частицы?
4. Определите понятия - полярные диаграммы, электронное облако, граничная поверхность электронного облака? Приведите изображение граничных поверхностей электронных облаков: 4s, 4px, 4py, 4pz, 4dxy, 4dxz, 4dyz, 4dx2-y2, 4dz2.
5. Постройте и обоснуйте графическую зависимость первого и второго потенциалов ионизации атомов химических элементов третьего периода в зависимости от номера группы.
| Элемент | Na | Mg | Al | Si | P | S | Cl | Ar |
| I1, эВ | 5.14 | 7.64 | 6.00 | 8.15 | 10.5 | 10.4 | 13.0 | 15.8 |
| I2, эВ | 47.3 | 15.0 | 18.8 | 16.3 | 19.7 | 23.4 | 23.8 | 27.6 |
Вариант 11.
1. Что такое полярные координаты и как они связаны с декартовой системой координат? В чем смысл перехода к полярным координатам при решении уравнения Шреденгера для атома водорода? Что значит решить уравнение Шреденгера? Что такое радиальная и угловые составляющие волновой функции и как они связаны с полной волновой функцией? Что такое собственные волновые функции электрона. От каких параметров зависят собственные волновые функции электрона в атоме водорода, их угловые и радиальные составляющие?
2. Для изучения структуры молекул (определения пространственного расположения атомов в их составе) используют потоки нейтронов, движущихся с кинетической энергией в интервале 8×10-21 ¸ 1,6×10-20 Дж. Каков интервал длин волн такого «излучения»? Сопоставьте рассчитанный интервал длин волн нейтронного излучения с размерами молекул (10-8¸10-9 м) и атомов (~10-10 м) и обоснуйте выбор интервала кинетической энергии потока нейтронов для изучения структуры молекул.
3. Относительная атомная масса Rb равна 85.47. Природная смесь Rb состоит из стабильного изотопа 85Rb и радиоактивного изотопа 87Rb. Сколько процентов каждого изотопа находится в природной смеси?
4. Определите понятия – квантовый уровень, квантовый подуровень. Каково соотношение между номером квантового уровня и числом - подуровней и атомных орбиталей уровня? Чему равна кратность вырождения атомных орбиталей третьего уровня для иона Be3+ и атома Be?
5. Дайте определение энергии (потенциала) ионизации атома. Как и почему изменяется величина энергии ионизации в ряду элементов: а) третьего периода, б) лантаноидов?
Вариант 12.
1. Что такое одноэлектронное приближение и одноэлектронные волновые функции, используемые при описании электронного строения многоэлектронных атомов? От каких квантовых чисел и почему зависит энергия электрона на одноэлектронной атомной орбитали многоэлекронного атома?
2. Хлорофилл поглощает синий свет с длиной волны 460 нм и испускает красный свет с длиной волны 660 нм. Определите изменение энергии (в джоулях, электрон-вольтах, джоулях на моль) хлорофилла в результате поглощения и испускания света. Учитывая, что за единицу интенсивности светового излучения, называемой эйнштейном, принимают 1 моль фотонов, определите какова энергия 1 эйнштейна излучения с длиной волны 460 нм?
3. Для атома N 1s22s22p3 определите значения четырех квантовых чисел: n, l, m, ms, определяющих каждый из его семи электронов в основном состоянии.
4. Напишите сокращенные электронные и электронно-графические формулы следующих атомов и ионов: а) K и K+; б) Si и Si2+; в) Se и Se4+; г) Mn, Mn2+, Mn4, Mn6+; д) La и La3+.
5. Почему существует несколько типов радиусов атомов и ионов химических элементов? Какие типы радиусов атомов и ионов распространены в химической практике? Как и почему изменяется величина радиуса: атомов химических элементов: а) четвертого периода, б) лантаноидов? Что такое d- и f-сжатие? Как и почему изменяется величина ионного радиуса в ряду изоэлектронных ионов: O2-, F-, Na+, Mg2+, Al3+?
Вариант 13.
1. Какой принцип природы и почему лежит в основе периодического закона? Определите термины: периодический закон, периодическая система, периодическая таблица. Проведите анализ достоинств и недостатков следующих типов периодических таблиц: короткопериодная, длиннопериодная, пирамидальная.
2. Определите энергию фотонов, требуемую для перехода электрона в атоме водорода из состояний: 1s ® 2p, 2p ® 3s, 2p ® 3p, 2p ® 3d, 1s ® 4f.
3. В природной смеси кислорода атомы его стабильных изотопов находятся в следующем соотношении: 16O : 17O : 18O = 2545 : 1 : 5. Чему равна относительная атомная масса кислорода?
4. Укажите, какой из атомов каждой пары элементов и почему имеет большее значение радиуса, энергии ионизации, энергии сродства к электрону, относительной электроотрицательности: а) O, F; б) N, P; в) Sc, Ga; г) Ga, Si?
5. Атомам каких элементов и в каком состоянии - основном, возбужденном – соответствуют следующие электронные конфигурации:
1) 1s22s22p5; 2) 1s22s12p6; 3) [Ne]3s23d2; 4) [Ar]3d34s2; 5) 1s22s22p63d1;
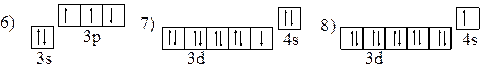 |
Вариант 14.
1. Что определяет номер периода? Сколько элементов и почему содержат элементы I-VI периодов? Какова электронная конфигурация первого и последнего элемента периода? Сколько элементов можно ожидать для элементов VII и VIII периодов?
2. Определите длину волны электрона и молекулы хлора, движущихся со скоростью, равной одной десятой скорости света. Можно ли экспериментально наблюдать волновые свойства потока таких частиц, каким образом? Можно ли указать место на экране, расположенным после прохождения потоком электронов «щели», куда попадет отдельный электрон?
3. Вычислите радиус, скорость движения и энергию электрона на 2 боровской орбите. Как изменятся эти величины для иона Li2+?
4. Дайте определение энергии ионизации и энергии сродства к электрону. На примере элементов 3 периода и VIA группы продемонстрируйте и обоснуйте внутрипериодический и вторичнопериодический характер изменения этих величин по периоду и группе.
5. Атомы каких элементов имеют электронные конфигурации: а) [Ne]2s1; б) [He]2s22p2; в) [Ar]3d74s2; г) [Ne]3s23p6; д) [Kr]4d105s25p3; е) [Kr]4d55s1; ж) [Xe]4f125s2? Классифицируйте элементы с точки зрения их электронного строения и положения в периодической системе.
Вариант 15.
1. Что является причиной внутренней и вторичной периодичности? На примере элементов 3 периода и VIIA группы продемонстрируйте проявление внутренней и вторичной периодичности в характере изменения энергии ионизации и энергии сродства к электрону атомов химических элементов.
2. Опишите опыты, в результате которых были установлены масса и заряд электрона. Сопоставьте массу электрона с массой атома H.
3. Определите энергию фотонов, требуемую для перехода электрона в ионе Li2+ из состояний: 1s®2s, 1s®2p, 1s®3p, 2p®3d, 1s®4f.
4. Объясните характер изменения энергии ионизации: I1®I2®I3 и Mg®Al®Si:
| Элемент | Mg | Al | Si |
| I1, эВ | 7.6 | 6.0 | 8.2 |
| I2, эВ | 15.0 | 18.8 | 16.3 |
| I3, эВ | 80.1 | 28.4 | 33.5 |
5. Сравните понятия – атомная орбита и атомная орбиталь, используемые в боровской и вероятностной модели для описания движения электрона в атоме. На каком расстоянии от ядра наиболее вероятно нахождение электрона в основном 1s состоянии и возбужденных - 2s, 3s и 4s состояниях для иона He+?
Дата добавления: 2015-06-10; просмотров: 2263;
