Синтез производных сахаров, подлежащих гликозилированию
Специфические трудности при синтезе олигосахаридов заключаются, прежде всего, в необходимости защиты всех гидроксильных групп полифункциональной молекулы сахара, играющего роль агликона, кроме той, которая подлежит гликозилированию. Поэтому первой задачей при синтезе олигосахарида является получение производного сахара, содержащего одну свободную гидроксильную группу в заданном положении. Для получения таких соединений используют практически все типы производных Сахаров, но наиболее важную роль среди них играют алкилиденовые производные, ацетаты и бензоаты, тозилаты, меркаптали, тритиловые и бензиловые эфиры и метил- и бензилгликозиды.
Естественно, что общих методов синтеза производных Сахаров со свободной гидроксильной группой в заданном положении не существует, однако можно сформулировать основные подходы к решению этой задачи.
Простейший подход состоит в непосредственной избирательной защите всех гидроксильных групп, кроме заданной. Чаще всего это удается с помощью изопропилиденовых производных. Так, например, были получены 1,2;3,4-ди-O-изопропилиден-α-D-галактопираноза со свободным гидроксилом при С6, 1,2;5,6-ди-О-изопропилиден-α-D-глюкофураноза со свободным гидроксилом при С3 и др. Нередко используют также ступенчатое введение защищающих групп различного типа, как, например, при синтезе 2-О-ацетил-4,6-O-бензилиден-α-метил-D-глюкопиранозида, содержащего свободный гидроксил при С3. Последовательность введения защищающих групп в этом случае такова [16]:
а) синтез α-метил-D-глюкопиранозида по Фишеру - защита полуацетального гидроксила;
б) синтез бензилиденового производного - защита гидроксилов при С4 и С6;
в) моноацетилирование - защита гидроксила при С2.
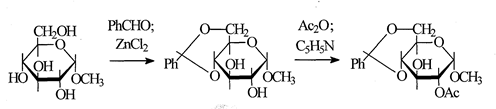
В синтезах этого типа избирательное введение защищающих групп на ключевых стадиях, как правило, достигается с помощью циклических производных - изопропилиденовых, бензилиденовых, реже циклокарбонатов и др.
Другой подход состоит в синтезе сполна защищенных производных Сахаров, содержащих защищающие группы разных типов, одну из которых затем избирательно удаляют с освобождением нужного гидроксила.
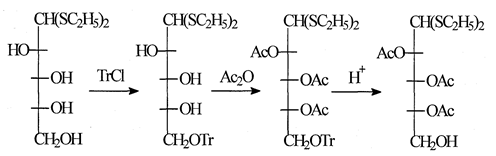
В качестве таких производных обычно используют тритиловые и бензиловые эфиры и некоторые другие производные. Этот прием лежит в основе двух общих методов синтеза производных Сахаров со свободным первичным гидроксилом и свободным полуацетальным гидроксилом. Первые из. них получают путем тритилирования, которое, как правило, избирательно проходит по первичному гидроксилу, после чего остальные гидроксилы защищают подходящими группами. Тритильную защиту затем удаляют гидрогенолизом или мягким кислотным гидролизом, например [17]:
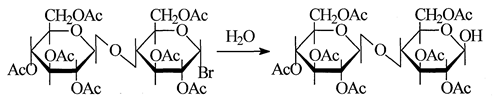
Производные со свободным полуацетальным гидроксилом получают гидролизом ацилгалогеноз, как, например [18]:
Сходным образом решается задача в тех случаях, когда необходимо произвести замену одних защищающих групп, неудобных по тем или иным причинам, другими с сохранением положения свободного гидроксила в молекуле. Так, например, была синтезирована 1,2,4,6-тетра-О-ацетил-β-D-глюкопираноза [19] (Способность алкилиденовых групп к миграции в 1,2;5,6-ди-О-изопропилиден-α-D-глюкофуранозе делает это соединение мало удобным для синтеза олигосахаридов):

Не редко приходится прибегать и к более сложной последовательности реакций, включающей оба указанных подхода, как это было сделано в синтезе мурамовой кислоты со свободным гидроксилом при С6 [20]:

В случае моносахаридов, которые содержат четыре - пять гидроксилов, почти всегда удается подобрать необходимое сочетание защищающих групп. Однако уже для дисахаридов, где число гидроксильных групп возрастает до шести - восьми, эта задача становится чрезвычайно сложной. Поэтому синтезы таких производных олигосахаридов известны лишь на весьма ограниченном числе примеров. Таков, например, синтез производного целлобиозы со свободным гидроксилом при С6 в восстанавливающем звене [21].
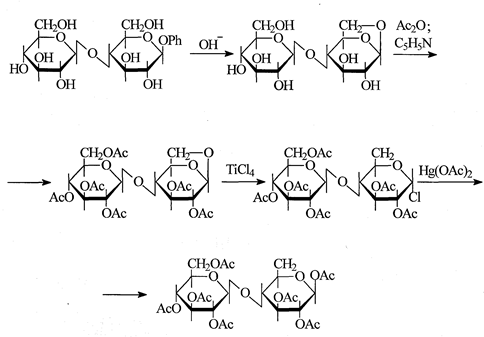
Для получения производных Сахаров, используемых для синтеза олиго-сахаридов, могут применяться только такие типы защищающих групп, которые инертны в условиях гликозилирования и в дальнейшем могут быть удалены без разрушения гликозидной связи и без изменения ее конфигурации в синтезированном олигосахариде. Так, например, применение метилгликози-дов для защиты альдегидной функции сахара неудобно при синтезе олигосахаридов, так как удаление такой группы без гидролиза олигосахаридной связи обычно затруднительно (тем не менее этот тип защиты был использован, например, в синтезе софорозы, где метилгликозидную связь удалось избирательно расщепить путем ацетолиза [22]). Поэтому для этой цели обычно используют бензилгликозиды, гидрогенолиз которых протекает гладко и не затрагивает другие типы гликозидных связей.
Широкое применение при синтезе олигосахаридов находит изопро-пилиденовая защищающая группа, которую обычно удается удалить мягким кислотным гидролизом, не затрагивающим гликозидные связи. Однако в случае синтеза лабильных к кислотам фуранозидов этот вид защиты неудобен.
Более универсальна бензилиденовая защита, удаляемая гидрированием или мягким кислотным гидролизом.
Особенно широкое применение в синтезе олигосахаридов находят аци-лированные производные Сахаров, которые гидролизуются щелочными агентами, обычно не действующими на гликозидные связи. Практически чаще всего используют ацетаты и бензоаты Сахаров.
Интересные возможности открывает применение ациклических производных Сахаров (ацеталей и меркапталей). Специфические условия гидролиза меркапталей Сахаров (катализ солями ртути и кадмия) позволяют использовать этот тип производных для синтеза олигосахаридов. Такая возможность была, например, продемонстрирована при синтезе 5-O-(α-L-арабинофуранозил)-L-арабинофуранозы, в которой меркаптальная защита была удалена без разрыва лабильной к кислотам арабинофуранозидной связи, так как введение алкилиденовых групп в эти соединения приводит к иному расположению защищающих группировок, нежели в циклических формах тех же моносахаридов. Так, например, ацетонирование D-глюкозы дает соединение со свободным гидроксилом при С3, тогда как из диметилди-тиоацеталя D-глюкозы получается производное со свободным гидроксилом приС4[23]:
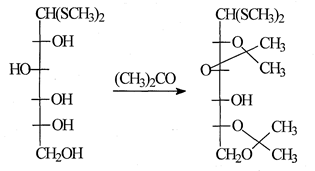
Обычно возможен синтез нескольких производных определенного моносахарида, содержащих один и тот же свободный гидроксил. При выборе наиболее подходящего производного необходимо руководствоваться не только соображениями удобства синтеза и пригодности применяемых защищающих групп. Не менее существенно, что реакционная способность гидроксильной группы в условиях гликозилирования весьма сильно зависит от способа защиты остальных гидроксилов, что определяет конформацию молекулы в целом, хотя закономерности такого влияния еще далеко не всегда ясны.
Таким образом, синтез производных Сахаров с заданной свободной гидроксильной группой представляет собой порой увлекательную, но в общем случае достаточно сложную задачу. Возможность синтеза олигосахарида, гликозидная связь в котором может быть введена существующими методами, в значительной мере определяется возможностями синтеза подходящих производных сахара со свободным гидроксилом в требуемом положении. Гликозилирование таких соединений, в общих чертах, протекает аналогично гликозилированию других сложных спиртов.
Дата добавления: 2015-04-05; просмотров: 1783;
