Использование закона действующих масс для расчета состава равновесных смесей.
Для определения состава системы при установившемся равновесии, а следовательно, и выхода продукта (продуктов) реакции необходимо знать константу равновесия и состав исходной смеси.
Состав исходной смеси всегда известен. Константа равновесия также может быть определена по уравнению изотермы химической реакции (смотри (V,9) и (V,10)) на основе термодинамического расчета изменения энергии Гиббса 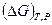 или
или 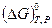 химической реакции.
химической реакции.
Рассмотрим два случая.
1. Реакция без изменения числа молекул.
Наиболее простые уравнения для расчета равновесного состава получают тогда, когда суммы стехиометрических коэффициентов в левой и правой частях химического уравнения будут равны, т.е. 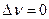 . Например,
. Например,
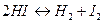
Для этого типа реакций согласно (V,5) и (V,5а)
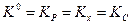
Примем, что исходная смесь содержит 1 моль иодида водорода. В процессе диссоциации распалось 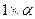 моль HI,где
моль HI,где 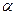 - степень диссоциации.
- степень диссоциации.
Диссоциация - процесс, заключающийся в распаде молекул на несколько более простых частиц — молекул, атомов, радикалов или ионов.
Степень диссоциации- отношение числа молекул, распавшихся при диссоциации, к их общему числу.
Следовательно, в равновесной смеси находится 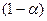 моль HI.
моль HI.
Количество водорода и йода, образовавшихся к моменту равновесия, будет равно 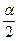 моль. Суммарное число молей в равновесной смеси совпадает с числом молей в исходной смеси, т.е.
моль. Суммарное число молей в равновесной смеси совпадает с числом молей в исходной смеси, т.е. 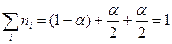 .
.
Тогда выражение для константы 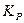 запишется следующим образом:
запишется следующим образом:
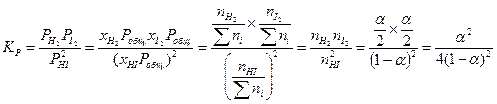
Зная константу 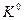 , а также соотношение между численно равной ей константой
, а также соотношение между численно равной ей константой 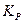 (если парциальные давления выражены в атм.) и степенью диссоциации, легко вычислить
(если парциальные давления выражены в атм.) и степенью диссоциации, легко вычислить 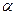 из последнего уравнения и определить число молей всех участников реакции в равновесной смеси, т.е. ее состав.
из последнего уравнения и определить число молей всех участников реакции в равновесной смеси, т.е. ее состав.
2. Реакция с изменением числа молекул.
В качестве примера реакции такого типа рассмотрим диссоциацию 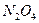
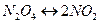
Снова примем, что исходная смесь содержит 1 моль 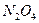 . В процессе диссоциации распалось
. В процессе диссоциации распалось 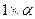 моль
моль 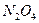 ,где
,где 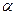 - степень диссоциации.
- степень диссоциации.
Следовательно, в равновесной смеси находится 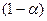 моль
моль 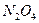 .
.
Количество диоксида азота 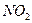 , образовавшегося к моменту равновесия, будет равно
, образовавшегося к моменту равновесия, будет равно 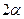 моль. Суммарное число молей в равновесной смеси
моль. Суммарное число молей в равновесной смеси 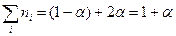 .
. 
Тогда выражение для константы 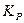 запишется следующим образом:
запишется следующим образом:
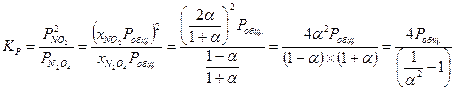 ,
,
где 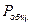 - общее давление равновесной смеси. Это давление всегда можно определить экспериментально, поэтому, как и в ранее рассмотренном примере, задача сводится к решению полученного уравнения относительно степени диссоциации
- общее давление равновесной смеси. Это давление всегда можно определить экспериментально, поэтому, как и в ранее рассмотренном примере, задача сводится к решению полученного уравнения относительно степени диссоциации 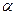 для определения состава системы.
для определения состава системы.
Отметим одну особенность полученного результата. В выражение для константы равновесия 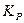 в явном виде входит давление, это находится в кажущемся противоречии с ранее сделанным утверждением, что константа зависит только от температуры. Дело в том, что любое изменение давления при протекании газофазных реакций с изменением числа молекул вызывает смещение равновесия. Из полученного нами уравнения для рассмотренного примера легко сделать вывод, что неизменность константы при увеличении давления в реакционной смеси возможна лишь при уменьшении степени диссоциации
в явном виде входит давление, это находится в кажущемся противоречии с ранее сделанным утверждением, что константа зависит только от температуры. Дело в том, что любое изменение давления при протекании газофазных реакций с изменением числа молекул вызывает смещение равновесия. Из полученного нами уравнения для рассмотренного примера легко сделать вывод, что неизменность константы при увеличении давления в реакционной смеси возможна лишь при уменьшении степени диссоциации 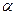 . И, наоборот, при уменьшении общего давления степень диссоциации будет увеличиваться. Следовательно, при изменении давления в ту или иную сторону реакция смещается справа налево или слева направо, но так, что обеспечивается постоянство
. И, наоборот, при уменьшении общего давления степень диссоциации будет увеличиваться. Следовательно, при изменении давления в ту или иную сторону реакция смещается справа налево или слева направо, но так, что обеспечивается постоянство 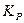 при заданной температуре.
при заданной температуре.
Влияние давления на равновесный выход продуктов зависит от стехиометрического типа реакции, т.е. от того, протекает она с увеличением или уменьшением числа молекул. При увеличении числа молекул (как в случае диссоциации 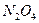 ) отклик системы на изменение давления будет противоположным такому же воздействию давления при протекании реакций с уменьшением числа молекул.
) отклик системы на изменение давления будет противоположным такому же воздействию давления при протекании реакций с уменьшением числа молекул.
К обсуждению влияния возмущающих воздействий на состояние равновесия мы вернемся позже в разделе, посвященном принципу Ле Шателье – Брауна (смотри §7 этой главы).
Дата добавления: 2015-05-21; просмотров: 1272;
