Химическое равновесие в неидеальных системах.
Закон действующих масс (V,5) применим, как уже говорилось, лишь к идеальным газам (или идеальным растворам). Для таких систем произведение равновесных относительных парциальных давлений реагирующих веществ, равное 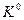 , не зависит от общего давления. Применение этого закона к реальным системам неизбежно носит приближенный характер, при этом неточность закона должна возрастать с увеличением давления и понижением температуры.
, не зависит от общего давления. Применение этого закона к реальным системам неизбежно носит приближенный характер, при этом неточность закона должна возрастать с увеличением давления и понижением температуры.
Ниже дан пример зависимости «константы» равновесия реакции 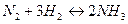
от давления (при t = 450°C):
| Р, атм. | |||||||

| 6,55×10-3 | 6,71×10-3 | 6,85×10-3 | 7,20×10-3 | 8,77×10-3 | 12,8×10-3 | 22,8×10-3 |
Из приведенных данных следует, что при изменении давления в системе от 10 до 1000 атм. «константа» изменяется почти в четыре раза, что связано с отклонением поведения реальных газов от идеальности.
Свойства реального газа существенно зависят от межмолекулярных взаимодействий. В обычных условиях, когда средняя потенциальная энергия взаимодействия молекул намного меньше их средней кинетической энергии, свойства реального газа незначительно отличаются от свойств идеального газа. Отличие свойств реального газа от свойств идеального газа становится особенно значительным при высоких давлениях и низких температурах.
Принципиально возможны два способа изучения равновесия в реальных системах.
Первый основан на использовании вместо закона идеального газа уравнения состояния реального газа (например, уравнения Ван-дер-Ваальса или какого-либо другого). А именно, в дифференциал 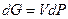 можно подставить V или dP, определенные из выбранного уравнения состояния, и далее вывести закон равновесия, заменяющий закон действующих масс. Этот путь использовался и оказался неудачным. Во-первых, любое уравнение состояния является приближенным и бóльшая точность связана с бóльшей сложностью уравнения. Во-вторых, само выражение закона зависело бы от выбранного в достаточной степени произвольно уравнения состояния. Таким образом, было бы неизбежно появление различных законов равновесия в зависимости от вкуса и требований автора, не говоря уже о математических сложностях, связанных с их выводом.
можно подставить V или dP, определенные из выбранного уравнения состояния, и далее вывести закон равновесия, заменяющий закон действующих масс. Этот путь использовался и оказался неудачным. Во-первых, любое уравнение состояния является приближенным и бóльшая точность связана с бóльшей сложностью уравнения. Во-вторых, само выражение закона зависело бы от выбранного в достаточной степени произвольно уравнения состояния. Таким образом, было бы неизбежно появление различных законов равновесия в зависимости от вкуса и требований автора, не говоря уже о математических сложностях, связанных с их выводом.
Иной путь решения задачи предложил Гилберт Льюис, который ввел в термодинамику понятия летучести (фугитивности) f и активности a.
Летучесть – величина, не имеющая определенного физического смысла, но будучи подставленной в уравнение, выведенное для идеального газа, летучесть делает его пригодным для реального газа. По этой причине летучесть иногда называют исправленным давлением.
Хотя этот прием является формально-математическим, однако он, бесспорно, оказался удобным и продуктивным.
Таким образом, летучесть (фугитивность) - термодинамическая величина, которая служит для записи зависимости химического потенциала индивидуальных веществ или компонентов смеси от параметров состояния (давления, температуры и состава).
Для индивидуального (реального) газа летучесть f (T,P) определяется соотношением:
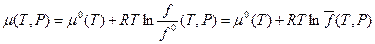 (V,18)
(V,18)
где μ(T, Р) - химический потенциал вещества, μ0(T) - его стандартный химический потенциал, равный химическому потенциалу в некотором гипотетическом состоянии, в котором при данной температуре и давлении равном 1атм., газ обладал бы свойствами идеального газа; 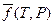 - относительная летучесть вещества; R – универсальная газовая постоянная. Кроме летучести чистого вещества, определяемой соотношением (V,18), для реальных газовых смесей вместо парциального давления вводят также парциальную летучесть. Делается это с помощью выражения (III,46) для химического потенциала компонента в смеси (парциального мольного изобарного потенциала):
- относительная летучесть вещества; R – универсальная газовая постоянная. Кроме летучести чистого вещества, определяемой соотношением (V,18), для реальных газовых смесей вместо парциального давления вводят также парциальную летучесть. Делается это с помощью выражения (III,46) для химического потенциала компонента в смеси (парциального мольного изобарного потенциала):
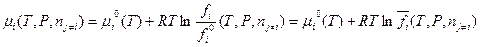 (V,19)
(V,19)
где 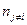 - число молей компонентов смеси, кроме i-ого компонента;
- число молей компонентов смеси, кроме i-ого компонента; 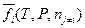 - относительная парциальная летучесть.
- относительная парциальная летучесть.
Из приведенного определения летучести следует, что она измеряется в единицах давления. Стандартное состояние в выражениях (V,18) и (V,19) относится к 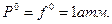
Так как с понижением давления поведение газа приближается к идеальному, то в пределе
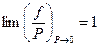
Широко применяется понятие коэффициента летучести, определяемого соотношением:
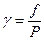 (V,20)
(V,20)
Коэффициент летучести характеризует степень отклонения газа от идеального, это безразмерная величина. Его численное значение может быть и меньше, и больше единицы. В пределе, когда Р стремится к нулю, коэффициент летучести стремится к единице:
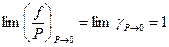
Перейдем к описанию химического равновесия в реальных системах. На основе общего условия равновесия реакции (IV,11), т.е. 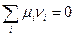 , а также выражения химического потенциала в форме (V,19), можем вывести уравнение изотермы реакции в реальной газовой смеси, по форме совпадающее с уравнением изотермы Вант-Гоффа, т.е.
, а также выражения химического потенциала в форме (V,19), можем вывести уравнение изотермы реакции в реальной газовой смеси, по форме совпадающее с уравнением изотермы Вант-Гоффа, т.е.
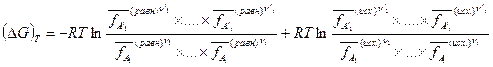 (V,21)
(V,21)
где 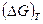 - изменение изобарного потенциала, соответствующее одному пробегу реакции при условии постоянства исходных значений летучестей
- изменение изобарного потенциала, соответствующее одному пробегу реакции при условии постоянства исходных значений летучестей 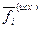 , стоящих во втором слагаемом справа. В первом слагаемом значения летучестей
, стоящих во втором слагаемом справа. В первом слагаемом значения летучестей 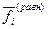 соответствуют равновесному состоянию.
соответствуют равновесному состоянию.
На основании (V,21) также можно записать закон действующих масс для реальной системы, по форме совпадающий с (V,5):
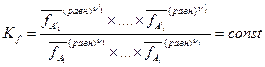
Если воспользоваться определением коэффициента летучести (V,20), то константу равновесия можно представить в таком виде:
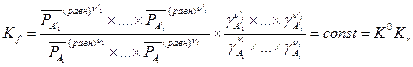
где вводится обозначение 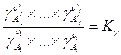 .
.
Дата добавления: 2015-05-21; просмотров: 1438;
