Методы расчета коэффициента летучести.
Чтобы вычислить летучесть, необходимо знать явную зависимость ее от давления при постоянной температуре.
Энергия Гиббса как функция давления и температуры определяется по уравнению ()
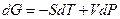
Тогда при T = const оно сводится к виду 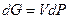 .
.
Интегрирование этого уравнения дает следующий результат:
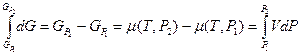
Если  , то свойства газа приближаются к свойствам идеального газа, т.е.
, то свойства газа приближаются к свойствам идеального газа, т.е. 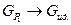 . Опуская индекс «2», в этом случае можем записать:
. Опуская индекс «2», в этом случае можем записать:
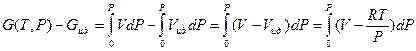 , (V,22)
, (V,22)
с учетом выражения 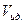 для одного моля идеального газа из уравнения Менделеева – Клапейрона.
для одного моля идеального газа из уравнения Менделеева – Клапейрона.
Если принять во внимание, что для одного моля вещества в газообразном состоянии
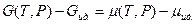 (V,23)
(V,23)
то подставив из (V,18) и (III,46) значения химического потенциала для реального и идеального газов, получим:
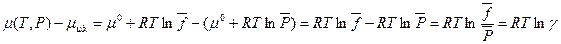 ( V,24)
( V,24)
Из сравнения уравнений (V,22), (V,23) и (V,24)следует, что
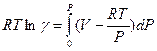

Или после простых преобразований:
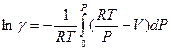 (V,25)
(V,25)
Разность 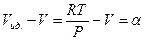 - это так называемая объемная поправка неидеального газа, учитывающая, что объем реального газа отличается от объема идеального газа.
- это так называемая объемная поправка неидеального газа, учитывающая, что объем реального газа отличается от объема идеального газа.
С учетом введенного обозначения уравнение (V,25) можно переписать следующим образом:
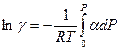 (V,26)
(V,26)
Полученное уравнение позволяет вычислять коэффициенты летучести по экспериментальным данным. Величину интеграла находят графически по площади под кривой 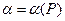 (смотри рис. )
(смотри рис. )
Другой графический метод расчета основан на использовании коэффициента сжимаемости. Коэффициентом сжимаемости z называется отношение 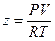 . Очевидно, что для идеального газа его значение равно единице, но отличается от единицы для реальных газов.
. Очевидно, что для идеального газа его значение равно единице, но отличается от единицы для реальных газов.
Если принять во внимание, что
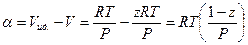
уравнение (V,26) можно преобразовать к следующему виду:
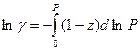
Полученный интеграл определяют графически по площади под кривой в координатах
(z – 1) – lnP.
Третий метод используют для определения коэффициента летучести по изотермам идеального и реального газов в координатах P – V от достаточно низкого давления, при котором эти изотермы практически сливаются, до давления, при котором требуется определить летучесть. Интеграл в правой части уравнения (V,25) определяют графически (смотри рис. ).
Еще один метод определения коэффициентов летучести основан на принципе соответственных состояний (метод Ньютона). Согласно этому принципу при одинаковых приведенном давлении 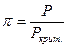 и приведенной температуре
и приведенной температуре 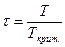 значения коэффициента летучести для различных веществ должны быть одинаковыми. Из понятия соответственного состояния вытекает, что коэффициент сжимаемости z, который учитывает степень отклонения неидеальных систем от идеальной, в критическом состоянии для всех веществ должен быть одинаков:
значения коэффициента летучести для различных веществ должны быть одинаковыми. Из понятия соответственного состояния вытекает, что коэффициент сжимаемости z, который учитывает степень отклонения неидеальных систем от идеальной, в критическом состоянии для всех веществ должен быть одинаков: 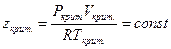 .
.
В действительности же, его величина зависит от природы вещества. На этом основании составлены таблицы, где при определении значений коэффициентов летучести учитываются не только приведенные температура и давление, но и различные значения 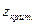 . Таким образом, при близости вещества к насыщенному состоянию
. Таким образом, при близости вещества к насыщенному состоянию 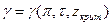 .
.
Зависимость коэффициента летучести от приведенного давления при различных приведенных температурах и значениях 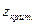 может быть представлена на графиках, используемых для тех же определений (смотри рис. ).
может быть представлена на графиках, используемых для тех же определений (смотри рис. ).
§ 10. Зависимость энтальпии веществ и тепловых эффектов химических реакций от давления.
При рассмотрении зависимости энтальпии от давления воспользуемся ее определением 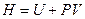 .
.
Продифференцируем это выражение по давлению при условии постоянства температуры:
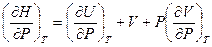 (V,27)
(V,27)
Теперь запишем известное нам выражение для dU:
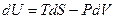
Разделим его на dP при условии постоянства температуры
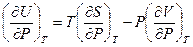 (V,28)
(V,28)
Теперь, если принять во внимание соотношение Максвелла (III.32), согласно которому 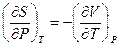 и подставить его в (V,28), получим:
и подставить его в (V,28), получим:
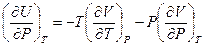 (V,29)
(V,29)
Это выражение подставим в (V,27) и после сокращений запишем
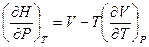
Если обе части последнего уравнения умножить на dP и проинтегрировать от Р = 1 атм. до Р при T = const, то это позволит определить абсолютную энтальпию вещества
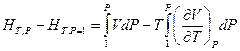 или
или 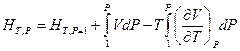
Аналогичное выражение можно записать для теплового эффекта химической реакции:
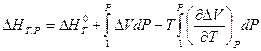
где 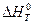 - тепловой эффект химической реакции при стандартных условиях, а
- тепловой эффект химической реакции при стандартных условиях, а 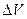 - изменение объема системы в результате реакции.
- изменение объема системы в результате реакции.
Теплоту реакции при любом давлении можно вычислить из полученного уравнения, если экспериментальные данные позволяют вычислить интегралы в его правой части.
Однако на практике поступают иначе, используя значения функции 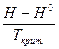 для веществ, участвующих в реакции. Она зависит от приведенных температуры и давления. Ее значение, которое дается в виде графиков или таблиц, позволяет учесть изменение энтальпии с изменением давления, а затем рассчитать тепловой эффект химической реакции при заданных условиях.
для веществ, участвующих в реакции. Она зависит от приведенных температуры и давления. Ее значение, которое дается в виде графиков или таблиц, позволяет учесть изменение энтальпии с изменением давления, а затем рассчитать тепловой эффект химической реакции при заданных условиях.
[1] Все сказанное выше относительно испарения действительно и для процесса возгонки (сублимации).
Дата добавления: 2015-05-21; просмотров: 2388;
