Термодинамика гальванического элемента.
Пусть в электрохимическом элементе протекает реакция вида:
M + Nn+ = Mn+ + N.
Работа, производимая элементом при растворении 1 моля вещества М, определяется произведением величины заряда q = n 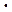 e-
e- 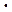 NA = nF на величину разности потенциалов между электродами, называемую электродвижущей силой (ЭДС) гальванического элемента:
NA = nF на величину разности потенциалов между электродами, называемую электродвижущей силой (ЭДС) гальванического элемента:
A = n 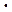 F
F 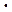 E, (9.1)
E, (9.1)
где Е - ЭДС гальванического элемента, В.
Если элемент работает обратимо в условиях р = const, то
A = n 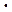 F
F 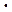 E = -
E = -  GT. (9.2)
GT. (9.2)
Из (9.2) очевидно, что Е определяется величиной А. Дифференцируя (9.2):
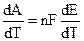 , (9.3)
, (9.3)
и подставляя (9.3) в уравнение Гиббса - Гельмгольца (4.72):
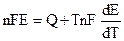 . (9.4)
. (9.4)
Из (9.4) следует:
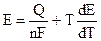 ,
,
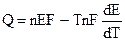 . (9.5)
. (9.5)
Уравнения (9.5) - это уравнения Гиббса - Гельмгольца для гальванического элемента.
Тепловой эффект химической реакции, происходящей в гальваническом элементе в соответствии с (9.5) может быть представлен в виде:
Q = A + Q’, (9.6)
где Q’ - часть теплового эффекта химической реакции.
В соответствии с (9.5):
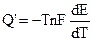 . (9.7)
. (9.7)
Итак, если при работе гальванического элемента энергия выделяется в окружающую среду (Q’ > 0), то 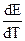 < 0 (9.7). Это означает, что с увеличением температуры ЭДС гальванического элемента уменьшается.
< 0 (9.7). Это означает, что с увеличением температуры ЭДС гальванического элемента уменьшается.
Если работа гальванического элемента сопровождается поглощением энергии из окружающей среды (Q’ < 0), то 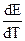 > 0, т. е. ЭДС гальванического элемента будет увеличиваться при увеличении температуры. Гальванические элементы - эталоны, например гальванический элемент Вестона, характеризуется тем, что у них
> 0, т. е. ЭДС гальванического элемента будет увеличиваться при увеличении температуры. Гальванические элементы - эталоны, например гальванический элемент Вестона, характеризуется тем, что у них 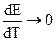 .
.
В соответствии с системой знаков, принятой в термохимии Q’ = -q, поэтому:
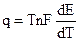 , (9.8)
, (9.8)
где q = T  S.
S.
Величина  S характеризует изменение энтропии при совершении реакции, протекающей в гальваническом элементе.
S характеризует изменение энтропии при совершении реакции, протекающей в гальваническом элементе.
Поэтому:
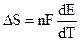 . (9.9)
. (9.9)
Работа химической реакции, протекающей в гальваническом элементе, связана с изменением активностей ионов в растворе, поэтому применение уравнения изотермы химической реакции дает:
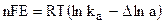 .
.
Отсюда
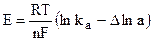 , (9.10)
, (9.10)
или
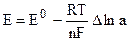 , (9.11)
, (9.11)
где 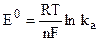 - стандартная (нормальная) ЭДС гальванического элемента. Из (9.11) следует, что Е0 равна ЭДС при активности всех участников реакции, равной единице.
- стандартная (нормальная) ЭДС гальванического элемента. Из (9.11) следует, что Е0 равна ЭДС при активности всех участников реакции, равной единице.
Для гальванического элемента Даниэля - Якоби, в котором протекает реакция
Zn + Cu2+ = Zn2+ + Cu,
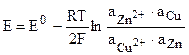 .
.
Активность чистых металлов постоянна и принимается единичной, поэтому ЭДС элемента Даниэля - Якоби равна
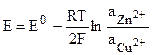 .
.
Дата добавления: 2015-05-21; просмотров: 3150;
