Классификация электродов и гальванических элементов.
Металл, помещенный в раствор, содержащий ионы этого металл, относится к электродам первого рода. В этом случае электродный потенциал определяется активностью катионов металла в электролите (см. уравнение (9.12))
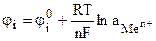 ,
,
и не зависит от активности анионов, то есть электрод обратим относительно катиона. Например, 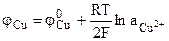 .
.
К электродам первого рода часто относят амальгамные электроды, отличающиеся тем, что вместо чистого металла используется раствор данного металла в ртути (амальгама), находящийся в контакте с раствором, содержащим ионы этого металла. Его потенциал зависит не только от активности ионов металла в растворе ( 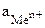 ), но и от активности металла в амальгамме (
), но и от активности металла в амальгамме ( 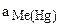 ):
):
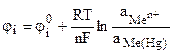 . (9.16)
. (9.16)
Иногда к электродам первого рода относят газовые электроды, обратимые относительно катиона или аниона. Такие электроды состоят из инертного металла, находящегося в одновременном контакте с газообразным веществом и с раствором, содержащим ионы этого вещества. Например, в водородном электроде имеется Pt - пластина, покрытая слоем электролитической Pt для обеспечения достаточной площади поверхности и помещенная в раствор, содержащий ионы водорода. К Pt - пластине подводится газообразный водород, обтекающий ее поверхность. Водородный электрод стандартный, если 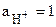 , а
, а 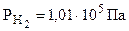 .
.
Водородному электроду H+ / H2(Pt) отвечает реакция H+ + e- = 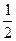 H2, а электродный потенциал его рассчитывается из уравнения:
H2, а электродный потенциал его рассчитывается из уравнения:
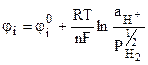 , (9.17)
, (9.17)
где 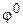 = 0.
= 0.
На хлорном электроде протекает реакция:
 Cl2 + e- = Cl-
Cl2 + e- = Cl-
для которой в соответствии с уравнением (9.11):
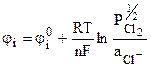 , (9.18)
, (9.18)
так как уравнение (9.11) справедливо и для отдельно взятого электрода гальванического элемента.
Электроды второго рода состоят из металла, покрытого слоем труднорастворимого соединения этого металла и помещенного в раствор соли, образующей такой же анион, как и труднорастворимые соединения металла. Примером является хлорсеребряный электрод Ag | KCl, AgCl(ТВ), содержащий серебрянную пластинку с осадком хлорида серебра в растворе хлорида калия.
Равновесие протекающей на нем реакция восстановления ионов серебра
Ag+ + e- = Ag (а)
определяется концентрацией ионов Ag+ в насыщенном растворе хлорида серебра и связано с реакцией:
AgCl = Ag+ + Cl-, (б)
равновесие которой, в свою очередь, зависит от концентрации ионов Cl-. Поэтому потенциал хлорсеребряного электрода в конечном итоге определяется концентрацией раствора хлорида калия. В соответствии с уравнениями (а) и (б) суммарная реакция имеет вид:
AgCl + e- = Ag + Cl-. (в)
Таким образом, в работе хлорсеребрянного электрода участвуют катионы и анионы. Электродный потенциал может быть рассчитан (см. уравнение (12.6)) на основании реакции (а)
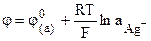
или суммарной реакции (в):
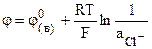 . (9.19)
. (9.19)
Другим представителем электрода второго рода является каломельный электрод, широко используемый на практике: Hg | KCl, Hg2Cl2(ТВ), состоящий из ртути, покрытой каломелью Hg2Cl2 и помещенной в раствор KСl.
На этом электроде протекают реакции:
Hg+ + e- = Hg (г)
 Hg2Cl2 = Hg+ + Cl- (д)
Hg2Cl2 = Hg+ + Cl- (д)
и суммарная реакция вида:
 Hg2Cl2 + e- = Hg + Cl-. (е)
Hg2Cl2 + e- = Hg + Cl-. (е)
Как обычно электродный потенциал рассчитывается в соответствии с уравнением (9.11):
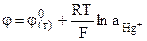 ,
,
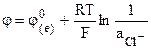 . (9.20)
. (9.20)
При получении уравнений (9.19) и (9.20) принимается, что активности чистых AgCl, Hg2Cl2, Ag и Hg равны единице. Электроды второго рода обладают высокой стабильностью потенциалов и применяются в качестве электродов сравнения.
Электроды третьего рода (редокс - электроды) характеризуются тем, что все участники электродной реакции находятся в растворе. Применяемый в них инертный металл - лишь резервуар электронов и непосредственного участия в электродном процессе не принимает. Например, электродом третьего рода является электрод Pt | Fe3+, Fe2+ состоящий из Pt - пластинки, находящейся в растворе, содержащем ионы Fe с различным зарядом (например, раствор FeCl2 и FeCl3). Pt - пластинка приобретает определенный потенциал вследствие того, что ионы Fe с различным зарядом превращаются друг в друга, отдавая ей излишние электроны или приобретая у нее недостающие.
На обсуждаемом электроде происходит реакция:
Fe3+ + e- = Fe2+.
Потенциал электрода соответственно (9.11) равен:
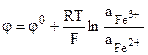 . (9.21)
. (9.21)
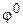 , как показывает (9.21) соответствует условию:
, как показывает (9.21) соответствует условию:
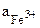 =
= 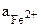 = 1.
= 1.
Гальванические элементы можно разделить на две группы:
а) химические гальванические элементы;
б) концентрационные гальванические элементы.
Химические гальванические элементы (например, гальванические элемент Даниэля - Якоби, Вестона) состоят из двух различных электродов, помещенных в растворы электролитов одинаковой концентрации. Для этих гальванических элементов характерно превращение энергии химической реакции в энергию электрического тока. К этой группе гальванических элементов принадлежит и гальванический элемент Вестона, используемый в качестве гальванического элемента - эталона.
Концентрационные гальванические элементы состоят из двух одинаковых электродов, помещенных в растворы различных концентраций. Опыт показывает, что электрод, погруженный в менее концентрированный раствор, является отрицательным электродом, а другой, погруженный в более концентрированный раствор - положительным.
Сопоставление опытных фактов приводит к заключению о том, что в основе работы всякого гальванического элемента лежат окислительно - восстановительные реакции, протекающие раздельно: на отрицательном электроде (аноде) - окисление, а на положительном (катоде) - восстановление.
При обозначении устройства гальванических элементов пользуются условной записью: вертикальными черточками обозначаются поверхности раздела фаз. Потенциал, возникающий на границе раздела двух растворов называется диффузионным. Чтобы подчеркнуть его отсутствие, в условной записи элемента используется двойная вертикальная черта:
Zn | ZnSO4 || CuSO4 | Cu.
Если в состав электрода гальванического элемента входит индифферентное, не участвующее в электродной реакции вещество, то его берут в скобки или отделяют запятой:
(Pt) H2 (p=1) | H+ (pH = 6) || KCl (1H), Hg2Cl2(ТВ) | Hg,
а составы фаз, их агрегатное состояние указываюся в скобках у символа фазы. Следуя этой же схеме, обозначается устройство электродов (полуэлементов).
Дата добавления: 2015-05-21; просмотров: 4741;
