Скорость химической реакции.
Количественно скорость химической реакции измеряется изменением концентрации продуктов реакции в единицу времени:
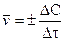 , (10.1)
, (10.1)
где 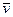 - средняя скорость химической реакции;
- средняя скорость химической реакции;
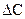 - изменение концентрации;
- изменение концентрации;
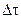 - промежуток времени.
- промежуток времени.
В ходе химической реакции ее скорость непрерывно изменяется, поэтому истинная скорость химической реакции (v) в любой момент времени есть отношение бесконечно малого изменения концентрации dC к бесконечно малому изменению времени 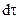 , в течении которого это изменение произошло:
, в течении которого это изменение произошло:
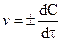 , (10.2)
, (10.2)
где знак “минус” относится к случаю уменьшения концентрации продукта в ходе химической реакции.
Следует помнить, что величины скоростей химических реакций, вычисленные по изменению концентраций различных продуктов химической реакции связаны между собой стехиометрическими коэффициентами.
Зависимость скорости химической реакции от концентрации ее продуктов выражается основным законом химической кинетики, сохранившем неточное название закона действующих масс. Он формулируется: “... скорость химической реакции в любой момент времени при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ, причем каждая из концентраций берется в степени равной коэффициенту перед формулой этого вещества в уравнении химической реакции” (закон Гульдберга - Вааге, 1867 г.).
В аналитической форме записи закон Гульдберга - Вааге имеет вид:
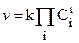 , (10.3)
, (10.3)
где k - константа скорости химической реакции.
Для химической реакции в произвольной форме записи
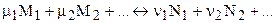
закон Гульдберга - Вааге дает:
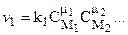 - для прямой реакции;
- для прямой реакции;
 - для обратной реакции;
- для обратной реакции;
k1 и k2 - константы скоростей прямой и обратной химических реакций соответственно.
Очевидно, что наблюдаемая или регистрируемая скорость химической реакции (v) вычислится:
v = v1 - v2. (10.4)
В ходе химической реакции концентрации исходных продуктов химической реакции уменьшаются и вместе с ними уменьшается и скорость прямой реакции. Одновременно растут концентрации конечных продуктов и, соответственно, скорость обратной реакции. Если v1 = v2, то v = 0 и наступает состояние химического равновесия:
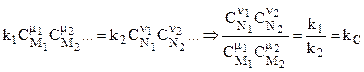 , (10.5)
, (10.5)
где kC - константа равновесия химической реакции, определенная ранее термодинамическим
методом.
Таким образом, в состоянии химического (термодинамического) равновесия процессы в системе, связанные с химическими реакциями не прекращяются, а непрерывно продолжаются во встречных направлениях с равными скоростями. Такое состояние называется еще состоянием динамического равновесия. Полученный вывод подтверждает тезис о том, что движение - единственно возможная форма существования материи.
Дата добавления: 2015-05-21; просмотров: 1124;
