Электродные потенциалы.
При переходе одного моля ионов из раствора на металл[5] (или обратно) совершается работа nF 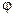 , где n - число моль-эквивалентов веществ, участвующих в реакции; F - число Фарадея,
, где n - число моль-эквивалентов веществ, участвующих в реакции; F - число Фарадея, 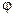 - разность потенциалов между металлом и раствором. Эта работа - работа системы по выравниванию химического потенциала вещества в контактных фазах и определяющаяся разностью химических потенциалов
- разность потенциалов между металлом и раствором. Эта работа - работа системы по выравниванию химического потенциала вещества в контактных фазах и определяющаяся разностью химических потенциалов 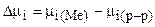
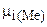 - величина, не зависящая от состава раствора, а
- величина, не зависящая от состава раствора, а 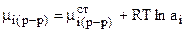 , где аi - активность ионов в растворе. Тогда справедливо равенство:
, где аi - активность ионов в растворе. Тогда справедливо равенство:
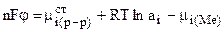
или
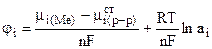 ,
,
где 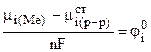 - постоянная для данной температуры и данного растворителя величина.
- постоянная для данной температуры и данного растворителя величина.
Окончательно:
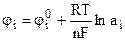 . (9.12)
. (9.12)
Величина 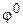 имеет простой физический смысл: это значение потенциала
имеет простой физический смысл: это значение потенциала 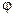 при
при 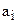 , равном единице. Она называется стандартным или нормальным потенциалом электрода и не зависит от состава раствора.
, равном единице. Она называется стандартным или нормальным потенциалом электрода и не зависит от состава раствора.
Величина стандартного потенциала, как уже указывалось ранее, служит мерой тенденции металла посылать ионы в раствор, т. е. той величиной, которую Нернст назвал электролитической упругостью растворения.
Если концентрация электролита m выражена в молях на 1 кг растворителя, то 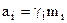 , где
, где 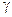 - коэффициент активности, поэтому
- коэффициент активности, поэтому
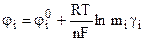 . (9.13)
. (9.13)
Наконец, если раствор сильно разбавлен, то для приближенных вычислений активность считается равной концентрации.
Тогда
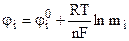 . (9.14)
. (9.14)
Знание значений электродных потенциалов позволяет рассчитать ЭДС гальванического элемента:
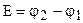 , (9.15)
, (9.15)
где 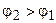 .
.
На первый взгляд могло бы казаться, что величину потенциала электрода относительно раствора найти легко. Однако современная наука не знает путей ни для измерения, ни для вычисления абсолютных величин отдельных электродных потенциалов. Незнание абсолютных величин и знаков отдельных электродных потенциалов ни в какой степени не отражается на дальнейших выводах, и не лишает их универсальности, так как реально измеряемыми величинами являются лишь разности потенциалов. Можно выбрать какой-нибудь, но всегда один и тот же электрод и условно считать его потенциал равным нулю. По ряду веских причин в качестве нулевого всегда берут потенциал стандартного водородного электрода с давлением Н2 в 1,01  105 Па и активностью Н+ в растворе, равной единице. Тогда потенциал любого электрода равен ЭДС элемента из этого электрода и стандартного водородного в том же растворителе и при той же температуре. Согласно последним соглашениям, электродный потенциал имеет отрицательный знак, если он более отрицателен, чем водородный и наоборот.
105 Па и активностью Н+ в растворе, равной единице. Тогда потенциал любого электрода равен ЭДС элемента из этого электрода и стандартного водородного в том же растворителе и при той же температуре. Согласно последним соглашениям, электродный потенциал имеет отрицательный знак, если он более отрицателен, чем водородный и наоборот.
Чаще всего, однако, потенциалы электродов измеряются не непосредственно против водородного, а против вспомагательного электрода, например каломельного или хлорсеребряного, потенциал которого относительно стандартного водородного надежно определен.
В таблице 9.1 даны величины стандартных потенциалов ряда электродов в воде при 25 0С, главным образом по данным новых точных измерений. Число значащих цифр отвечает достоверности величин потенциалов.
Таблица 9.1. Стандартные электродные потенциалы в водных растворах при 25 0С.
| Электрод | Электродная реакция | 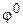 , В , В
| Электрод | Электродная реакция | 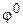 , В , В
| |
| Li+ / Li | Li+ + e- = Li | -3,04 | Ni2+ / Ni | Ni2+ + 2e- = Ni | -0,24 | |
| Rb+ / Rb | Rb+ + e- = Rb | -2,92 | Sn2+ / Sn | Sn2+ + 2e- = Sn | -0,136 | |
| K+ / K | K+ + e- = K | -2,92 | Pb2+ / Pb | Pb2+ + 2e- = Pb | -0,126 | |
| Ba2+ / Ba | Ba2+ + 2e- = Ba | -2,90 | Fe3+ / Fe | Fe3+ + 3e- = Fe | -0,036 | |
| Ca2+ / Ca | Ca2+ + 2e- = Ca | -2,87 | H+ / H2(Pt) | H+ + e- = 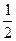 H2 H2
| 0,000 | |
| Na+ / Na | Na+ + e- = Na | -2,713 | Cu2+ / Cu | Cu2+ + 2e- = Cu | +0,337 | |
| Mg2+ / Mg | Mg2++2e- = Mg | -2,38 | Cu+ / Cu | Cu+ + e- = Cu | +0,52 | |
| Al3+ / Al | Al3+ + 3e- = Al | -1,66 | Hg22+ / Ag | 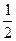 Hg22+ + e- = Ag Hg22+ + e- = Ag
| +0,798 | |
| Mn2+ / Mn | Mn2++2e- = Mn | -1,18 | Ag+ / Ag | Ag+ + e- = Ag | +0,799 | |
| Zn2+ / Zn | Zn2+ + 2e- = Zn | -0,763 | Hg2+ / Hg | Hg2+ + 2e- = Hg | +0,854 | |
| Cr3+ / Cr | Cr3+ + 3e- = Cr | -0,74 | Br- / Br2(Pt) | Br2 + 2e- = 2Br- | +1,066 | |
| Fe2+ / Fe | Fe2+ + 2e- = Fe | -0,44 | Cl- / Cl2(Pt) | Cl2 + 2e- = 2Cl- | +1,359 | |
| Cd2+ / Cd | Cd2+ +2e- = Cd | -0,402 | Au3+ / Au | Au3+ + 3e- = Au | +1,500 | |
| Co2+ / Co | Co2+ + 2e- = Co | -0,27 | F- /F2(Pt) | F2 + 2e- = 2F- | +2,870 |
Положительные величины 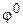 указывают на то, что при соединении со стандартным водородным электродом на данном электроде будет протекать реакция восстановления и он будет положительным электродом образовавшегося гальванического элемента. Отрицательные величины
указывают на то, что при соединении со стандартным водородным электродом на данном электроде будет протекать реакция восстановления и он будет положительным электродом образовавшегося гальванического элемента. Отрицательные величины 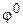 соответствуют тому, что данный электрод оказывается отрицательным, а процесс на нем пойдет в сторону его окисления.
соответствуют тому, что данный электрод оказывается отрицательным, а процесс на нем пойдет в сторону его окисления.
С помощью электрохимического ряда напряжений (табл. 9.1) можно установить характер электродных реакций, знак и величину ЭДС и в том случае, если потенциалы электродов элемента отличаются от стандартных. При этом ЭДС равна разности электродных потенциалов, каждый из которых вычисляется с помощью 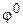 и с учетом активностей продуктов электродных реакций.
и с учетом активностей продуктов электродных реакций.
Стандартный потенциал 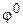 позволяет судить о способности вещества электрода окисляться и переходить в раствор: чем выше в ряду напряжений находится металл, тем более он активен, тем выше его способность окисляться, то есть вытеснять из раствора металл, располагающийся в более нижних строках ряда напряжений.
позволяет судить о способности вещества электрода окисляться и переходить в раствор: чем выше в ряду напряжений находится металл, тем более он активен, тем выше его способность окисляться, то есть вытеснять из раствора металл, располагающийся в более нижних строках ряда напряжений.
Дата добавления: 2015-05-21; просмотров: 1744;
