Возникновение электродвижущих сил.
Любая окислительно - восстановительная реакция связана с перемещением электронов, поэтому может быть использована для получения электрического тока. При этом источником электрической энергии является энергия, освобождающаяся при химической реакции. Такое превращение энергии химической реакции в электрическую возможно лишь с помощью специального устройства - гальванического элемента. Как и за счет чего гальванический элемент направляет поток электронов по проводникам?
Для ответа на вопрос требуется осмысление ряда ситуаций.
1. При помещении металлической пластины в воду происходит частичное ее растворение, имеющее специфический характер - каждый ион металла (Меn+), уходя в раствор, оставляет на металлической поверхности равный отрицательный заряд в виде свободных электронов. Отрицательно заряженная поверхность притягивает из раствора положительно заряженные ионы, формируя на границе раздела фаз двойной электрический слой, препятствующий дальней-
шему растворению металла. Постепенно система переходит в состояние термодинамического равновесия и процесс растворения металла прекращается.
2. При помещении металлической пластины в водный раствор соли данного металла, диссоциирующей с образованием ионов металла, возможны следующие варианты ситуаций:
а) концентрация ионов металла мала, поэтому вероятность процесса растворения металла больше вероятности процесса осаждения металла из раствора. Повторяется ранее приведенная ситуация, вследствие которой металл относительно раствора заряжается отрицательным зарядом;
б) если концентрация ионов металла в растворе велика. то преобладает процесс осаждения ионов металла из раствора на пластину, которая зарядится положительным зарядом. Осаждение котионов из раствора будет происходить до тех пор, пока в системе пластина - раствор не установится состояние термодинамического равновесия.
Таким образом, переход ионов металла в раствор и обратно создает на границе раздела фаз двойной электрический слой, обладающий разностью потенциалов. Металл заряжается положительным или отрицательным зарядом относительно раствора в зависимости от концентрации раствора и способности (тенденции) посылать ионы в раствор.
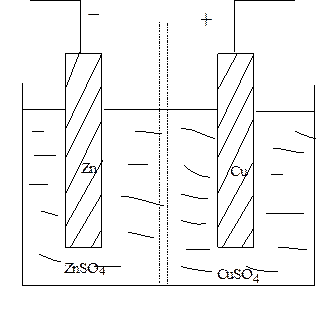
|
Тенденцию металла (электрода) посылать свои ионы в раствор В. Нернст назвал электролитической упругостью растворения. Далее будет показано, что количественной мерой электролитической упругости растворения является стандартный электродный потенциал ( 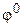 ).
).
Гальванический химический элемент (электрохимический элемент) включает в себя электроды, различающиеся своей природой. Так гальванический элемент Даниэля - Якоби (рис. 9.1) состоит из медной и цинковой пластин, помещенных в сернокислые растворы солей этих металлов. Растворы разделены пористой перегородкой, не позволяющей им перемешиваться.
| Рис. 9.1. Схема гальванического элемента Даниэля - Якоби. |
Так как электролитическая упругость растворения цинка больше, чем у меди, то Zn - электрод относительно раствора зарядится большим отрицательным зарядом, чем Cu - электрод.
При соединении электродов проводником, вследствие разности потенциалов между ними, в проводнике возникнет электрический ток: электроны будут переходить через проводник с Zn - электрода на Cu - электрод.
Уменьшение числа электронов на Zn - электроде будет компенсироваться его растворением, освобождающем новые электроны:
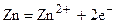 ,
,
а увеличение числа электронов на Cu - электроде будет компенсироваться осаждением из раствора ионов меди:
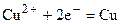 .
.
Суммарно в гальваническом элементе будет происходить реакция:
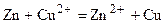 ,
,
служащая источником электрического тока в замыкающем электроды проводнике.
Дата добавления: 2015-05-21; просмотров: 944;
