Сильные и слабые электролиты.
По способности к диссоциации электролиты делятся на слабые и сильные.
Степень диссоциации слабых электролитов незначительна. В соответствии с теорией Аррениуса можно считать. что диссоциация слабых электролитов идет не до конца и в растворах таких электролитов устанавливается равновесие двух процессов: диссоциации молекул на ионы и рекомбинации противоположно заряженных ионов в молекулы. Разбавление электролита уменьшает вероятность процесса рекомбинации, что приводит к росту степени диссоциации и обращению ее при бесконечном разбавлении в единицу. Силами взаимодействия между ионами слабого электролита можно пренебречь. К слабым электролитам относятся водные растворы большинства органических кислот, оснований и некоторых солей.
Уравнение процесса диссоциации слабого электролита:
АВ 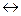 А+ + В-.
А+ + В-.
Константа диссоциации:
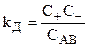 .
.
Другими словами, процесс диссоциации молекул слабого электролита - химически обратимая реакция, состояние термодинамического равновесия которой количественно характеризуется константой равновесия.
Другую группу электролитов составляют сильные электролиты. Закон действующих масс для сильных электролитов неприменим, а объяснить их свойства на основе теории Аррениуса невозможно.
Для объяснения свойств растворов сильных электролитов было выдвинуто предположение об их полной диссоциации ( 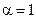 ) при любых концентрациях и о значительном взаимодействии ионов между собой.
) при любых концентрациях и о значительном взаимодействии ионов между собой.
Сильными электролитами являются расплавы, водные растворы большинства солей, кислот и щелочей.
Термодинамический метод позволяет изучать свойства сильных электролитов без рассмотрения природы составляющих их частиц и характера взаимодействий между ними. Электрическое взаимодействие ионов приводит к более значительным отклонениям растворов электролитов от идеальности, чем растворов неэлектролитов той же концентрации. Поэтому растворы сильных электролитов следует рассматривать как неидеальные и использовать не концентрации, а активности (Г. Н. Льюис).
Пусть процесс диссоциации сильного электролита описывается уравнением:
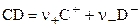 ,
,
причем моляльная концентрация электролита m, а его активность а. Следует помнить при этом, что активность характеризует свойства реального раствора независимо от того, чем отклонение этих свойств от идеальности обусловлено. Отличие активности электролита от концентрации связано с частичной или полной диссоциацией его молекул на ионы, появлением сил электростатического взаимодействия и т. д. Активность учитывает все причины, вызывающие отклонения от идеальности.
Раствор электролита содержит катионы с концентрацией m+ и активностью а+ и анионы с концентрацией 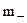 и активностью
и активностью 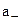 . Так как создать раствор, содержащий только один вид ионов невозможно, определив а+ и а-, принято использовать среднюю ионную концентрацию
. Так как создать раствор, содержащий только один вид ионов невозможно, определив а+ и а-, принято использовать среднюю ионную концентрацию 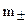 и среднюю ионную активность
и среднюю ионную активность 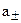 :
:
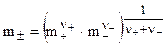 , (8.4)
, (8.4)
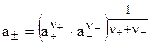 . (8.5)
. (8.5)
Аналогично определяется и средний ионный коэффициент активности:
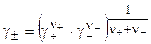 . (8.6)
. (8.6)
При полной диссоциации вещества CD:
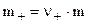 ,
, 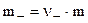 . (8.7)
. (8.7)
и средняя ионная активность вычислится:
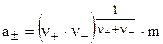 . (8.8)
. (8.8)
При 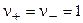 ,
, 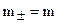 , т. е. средняя ионная концентрация равна концентрации электролита в целом. Связь между активностью электролита и активностями ионов выражается уравнением:
, т. е. средняя ионная концентрация равна концентрации электролита в целом. Связь между активностью электролита и активностями ионов выражается уравнением:
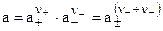 . (8.9)
. (8.9)
Активность электролита вычислится, если известна его концентрация и коэффициент активности ( 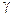 ):
):
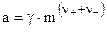 , (8.10)
, (8.10)
который рассчитывается:
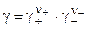 . (8.11)
. (8.11)
Для оценки зависимости коэффициента активности от концентрации в растворах, где присутствуют несколько диссоциирующих веществ Льюис и Рэндалл ввели понятие ионной силы электролита (I), характеризующей интенсивность электрического поля, действующего на ионы в растворе.
Правило ионной силы.
Средний коэффициент активности электролита определяется только ионной силой раствора и не зависит от природы и концентрации отдельных ионов.
Ионная сила раствора определяется как полусумма концентраций ионов, умноженных на квадрат их заряда (n):
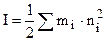 . (8.12)
. (8.12)
Коэффициент активности бесконечно разбавленного раствора принимается за единицу. С ростом концентрации 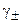 сначала уменьшается, что связано с ростом сил притяжения между ионами, а затем, когда происходит значительное возрастание сил отталкивания, он увеличивается и принимает значения, большие единицы.
сначала уменьшается, что связано с ростом сил притяжения между ионами, а затем, когда происходит значительное возрастание сил отталкивания, он увеличивается и принимает значения, большие единицы.
Электростатическая теория сильных электролитов предложена Дебаем и Гюккелем в 1923 г. В основе ее лежат следующие положения.
1. Ионы электролита взаимодействуют друг с другом. Силы взаимодействия электростатические и могут быть рассчитаны по законам электростатики.
2. Растворитель влияет на взаимодействие ионов.
3. Взаимодействие иона (центрального) с окружающими его ионами электролита в среднем равноценно его взаимодействию с воображаемой ионной атмосферой.
4. Размерами центрального иона можно пренебречь и считать его точечным зарядом.
Каждый ион электролита является центральным, окруженным своей ионной атмосферой. Ввиду того, что электролит в целом незаряжен, суммарный заряд ионной атмосферы всегда равен, но противоположен по знаку заряду центрального иона.
Предположение об электростатическом взаимодействии ионов объясняет отличие растворов сильных электролитов от идеальных. Вычисляя работу образования ионной атмосферы, можно количественно оценить степень отклонения от идеального состояния и найти коэффициент активности. В результате получается уравнение предельного закона Дебая - Гюккеля, справедливое для сильно разбавленных бинарных растворов сильных электролитов:
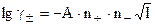 , (8.13)
, (8.13)
где 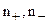 - заряды ионов;
- заряды ионов;
I - ионная сила раствора;
А - постоянная, зависящая от температуры и диэлектрической проницаемости растворителя.
Уравнение (8.13) теоретически обосновывает правило ионной силы, так как подтверждает, что при I = const 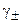 всех электролитов одинаков и не зависит от их природы.
всех электролитов одинаков и не зависит от их природы.
Электростатическая теория позволяет рассчитать ряд свойств растворов сильных электролитов, которые корректны лишь для весьма малых концентраций раствора, порядка 0,01 М и менее. Ряд фактов теория объяснить не может. Все это объясняется неточностью принятых допущений.
Были сделаны попытки уточнить уравнение предельного закона Дебая - Гюккеля, однако они, в свою очередь, содержат дополнительные допущения, а поэтому не вполне совершенны.
Дата добавления: 2015-05-21; просмотров: 2462;
