Термодинамика неидеальных растворов.
Полученные ранее соотношения непосредственно для описания равновесий с участием реальных растворов не могут быть использованы. Построение общей теории реальных растворов невозможно ввиду их многообразия.
Простое и универсальное решение этой задачи выполнил американский физико-химик Гилберт Ньютон Льюис. Он предложил учесть отклонения в поведении реальных растворов от идеальных заменой концентрации раствора его активностью (аi). После такой замены форма записи законов сохраняется прежней и удовлетворяет опытным данным.
Основная характеристика, описывающая поведение любого компонента раствора - его химический потенциал  . Для случая реального раствора:
. Для случая реального раствора:
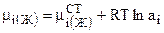 , (7.47)
, (7.47)
где  - химический потенциал компонента в стандартном состоянии.
- химический потенциал компонента в стандартном состоянии.
Очевидно, что стандартное состояние характеризуется значением ai = 1.
Стандартное состояние выбирается в зависимости от концентрации исследуемого реального раствора и удобства измерения давления насыщенного пара в этом состоянии. Существуют следующие варианты стандартных состояний:
а) состояние чистого компонента, достигаемое экстраполяцией закона Рауля до Ni = 1;
б) гипотетическое состояние, достигаемое экстраполяцией закона Генри до Ni = 1;
в) состояние компонента в растворе с его массовым процентом, равном единице.
Расчет ai можно выполнить по нижеследующей схеме.
Если реальный раствор находится в равновесном состоянии, то:
 ,
,
где 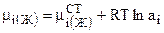 , а
, а 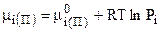 , тогда
, тогда
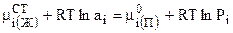 . (7.48)
. (7.48)
Для стандартного состояния, как и для любого другого, справедливо равенство:
 ,
,
где
 . (7.49)
. (7.49)
Равенство (7.48) с учетом (7.49) принимает вид:
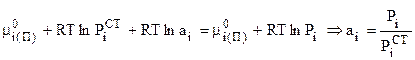 . (7.50)
. (7.50)
Для случая концентрированных растворов (вариант а) активность растворенного вещества (  ) определяет отклонения от закона Рауля:
) определяет отклонения от закона Рауля:
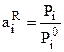 , (7.51)
, (7.51)
где Рi - давление насыщенного пара над реальным раствором;
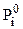 - давление насыщенного пара над чистым компонентом.
- давление насыщенного пара над чистым компонентом.
Из закона Рауля следует:
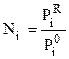 . (7.52)
. (7.52)
Совместное решение (7.51) и (7.52) дает:
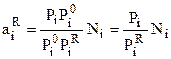 ,
,
где 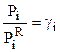 - коэффициент активности.
- коэффициент активности.
Окончательно:
 . (7.53)
. (7.53)
Для случая разбавленных растворов (вариант б) активность растворенного вещества ( 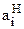 ) устраняет отклонения от закона Генри:
) устраняет отклонения от закона Генри:
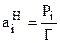 , (7.54)
, (7.54)
где Г - постоянная Генри или давление насыщенного пара i-го компонента над раствором в
стандартном состоянии.
Из закона Генри следует, что:
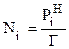 . (7.55)
. (7.55)
Совместное решение (7.52) и (7.53) позволяет получить соотношение:
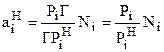 ,
,
где 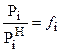 - коэффициент активности.
- коэффициент активности.
Тогда окончательно:
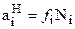 . (7.56)
. (7.56)
Если в растворе имеет место реакция А + 2В = 3С, то закон действующих масс запишется:
 , (7.57)
, (7.57)
где 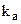 - константа равновесия;
- константа равновесия;
аА, аВ, аС - активности продуктов химической реакции.
Уравнение изотермы химической реакции с участием растворов приобретает следующую форму записи:
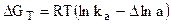 , (7.58)
, (7.58)
где 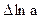 - алгебраическая сумма логарифмов начальных активностей реагентов.
- алгебраическая сумма логарифмов начальных активностей реагентов.
Дата добавления: 2015-05-21; просмотров: 1004;
