Химический потенциал.
Если в качестве экстенсивного свойства выбирается энергия Гиббса раствора (G), то ее величина, в отличие от значения G для идеального газа (4.67), зависит еще и от чисел молей компонентов раствора:
G = f (P, T, n1, n2, ...). (7.33)
Согласно (7.25) парциальная мольная энергия i-го компонента раствора 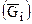 вычислится:
вычислится:
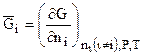 . (7.34)
. (7.34)
Величина 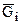 названа Дж. У. Гиббсом химическим потенциалом i-го компонента смеси, обозначаемая как
названа Дж. У. Гиббсом химическим потенциалом i-го компонента смеси, обозначаемая как 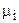 .
.
После введения (7.34) в (7.26):
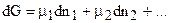 . (7.35)
. (7.35)
В состоянии термодинамического равновесия dG = 0, поэтому условие термодинамического равновесия в гетерогенной системе при Р = const и Т = const запишется в виде:
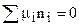 . (7.36)
. (7.36)
Химический потенциал - интенсивная характеристика компонента раствора и, согласно (7.36), условием равновесия системы является равенство 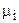 в различных ее частях.
в различных ее частях.
Практически важно, таким образом, уметь рассчитывать значения 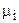 для различных систем.
для различных систем.
1. Система “идеальный газ”.
Известно (4.67), что dG = Vdp - SdT. В изотермических условиях dG = Vdp, где 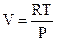 . Поэтому:
. Поэтому: 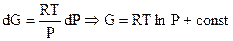 . Для Р = 1 (стандартные условия) const = G0. Окончательно:
. Для Р = 1 (стандартные условия) const = G0. Окончательно:
G = G0 + RTlnP. (7.37)
Но в идеальных системах парциальные молярные характеристики совпадают с молярными, поэтому, считая насыщенный пар идеальным газом, окончательно:
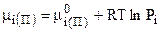 , (7.38)
, (7.38)
где 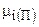 - химический потенциал i-го компонента, находящегося в газообразном состоянии;
- химический потенциал i-го компонента, находящегося в газообразном состоянии;
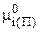 - то же, но в стандартных условиях;
- то же, но в стандартных условиях;
Рi - парциальное давление i-го компонента газовой смеси (насыщенного пара).
2. Система “чистая жидкость - насыщенный пар”.
Так как система находится в состоянии термодинамического равновесия, то
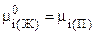 , (7.39)
, (7.39)
где 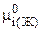 - химический потенциал чистого вещества в жидком состоянии.
- химический потенциал чистого вещества в жидком состоянии.
С учетом (7.38):
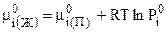 , (7.40)
, (7.40)
где 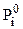 - парциальное давление насыщенного пара над чистой жидкостью.
- парциальное давление насыщенного пара над чистой жидкостью.
3. Система “раствор - насыщенный пар”.
Система находится в состоянии термодинамического равновесия, поэтому имеет место равенство:
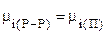 , (7.41)
, (7.41)
где 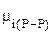 - химический потенциал i-го компонента в растворе.
- химический потенциал i-го компонента в растворе.
С учетом (7.38):
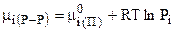 , (7.42)
, (7.42)
где
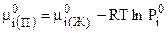 . (7.43)
. (7.43)
Тогда (7.42) после замены 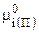 из (7.43) примет вид:
из (7.43) примет вид:
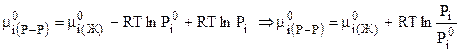 . (7.44)
. (7.44)
Если поведение i-го компонента описывается законом Рауля, то:
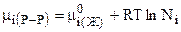 , (7.45)
, (7.45)
где Ni - мольная доля i-го компонента раствора.
Для системы “разбавленный раствор - пар” в состоянии теромодинамического равновесия:
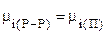
и с учетом (7.38)
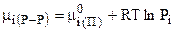 ,
,
где Рi = Г 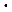 Ni.
Ni.
Тогда:
 , (7.46)
, (7.46)
где 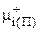 - химический потенциал i-го компонента в гипотетическом состоянии.
- химический потенциал i-го компонента в гипотетическом состоянии.
Гипотетическое (надуманное) состояние достигается экстраполяцией закона Генри до Ni=1, при условии, что раствор остается разбавленным.
Дата добавления: 2015-05-21; просмотров: 1181;
