Теория электролитической диссоциации.
Гипотеза электролитической диссоциации, объясняющая причину образования ионов в растворе электролита была выдвинута Сванте Аррениусом в 1887 г. Разрабатывая гипотезу, С. Аррениус сформулировал два ее постулата.
Первый постулат. В растворах электролитов ионы существуют вне зависимости от наложения или отсутствия электрического поля.
С. Аррениусом вводится представление о частичной диссоциации электролитов:
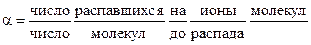 ,
,
где 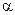 - степень диссоциации электролита, изменяющаяся в интервале от 0 до 1.
- степень диссоциации электролита, изменяющаяся в интервале от 0 до 1.
Второй постулат. Растворы электролитов подчиняются законам разбавленных растворов.
По мнению С. Аррениуса соотношения, полученные для разбавленных растворов, выполняются и для растворов электролитов с той лишь разницей, что необходимо учесть увеличение числа растворенных частиц вследствие явления электролитической диссоциации. Это увеличение учитывается введением коэффициента диссоциации (i).
В этой связи величины 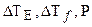 и др. примут более высокие значения, так как i > 1:
и др. примут более высокие значения, так как i > 1:
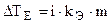 ;
; 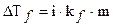 ; p’ = icRT.
; p’ = icRT.
Величины 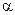 и i взаимосвязаны:
и i взаимосвязаны:
i = 1 + 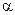 (m - 1),
(m - 1),
где m - число ионов, образующихся при разрушении молекулы.
Дата добавления: 2015-05-21; просмотров: 844;
