Нижній ряд показує спектри поглинання, що відповідають певному типу забарвлення берилу, що виникають в результаті поєднання в одному мінералі різних схем перенесення заряду.
Необхідні концентрації феруму та титану в складі корунду не перевищують 0.01 ваг. %. Аналогічною є природа синього забарвлення кіанітуAl2O[SiO4].
Різні відтінки синього забарвлення мінералів пов’язані із перенесенням заряду в парі Fe2+ ↔ Fe3+, що заселяють сусідні кристалохімічні позиції в кристалічній структурі. Такою є природа зелено-синього забарвлення вівіаніту, берилу (аквамарину), синє і синьо-фіолетове – кордієриту (йоліту), турмалінів, діопсиду.
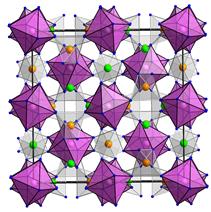
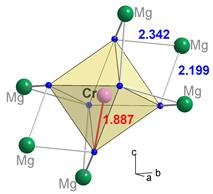
В одному мінералі можуть реалізовувати різні варіанти одного механізму поглинання. Характерним прикладом цього є кільцевий силікат берил Be3Al2[Si6O18]. Перенесення заряду у його кристалічній структурі пов’язане із ізоморфними доміками Fe2+ і Fe3+.
У структурі берилу існує декілька кристалохімічних позицій, що можуть приймати ці катіони (рис. 11.37а):
1. тетраедрична позиція Be2+;
2. октаедрична позиція Al3+;
3. тригонально-призматична вакансія (КЧ=6) між двома октаедричниим позиціями.
Заміщення відбувається за наступними схемами:
1. 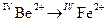
2. 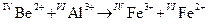
3. 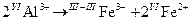
Трьохвалентне залізо може знаходитися в одній із трьох можливих позицій, в кожній із яких може реалізовуватися перенесення заряду із специфічними смугами поглинання у видимому діапазоні:
1. перенесення заряду Fe3+↔O2- в октаедричній позиції 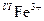 призводить до поглинання короткохвильової частини спектру (край поглинання);
призводить до поглинання короткохвильової частини спектру (край поглинання);
2. перенесення заряду Fe3+↔O2- в тетраедричній позиції 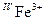 проявляється як смуга поглинання із максимум 12300 см-1 (червона частина спектру);
проявляється як смуга поглинання із максимум 12300 см-1 (червона частина спектру);
3. перенесення заряду Fe3+↔O2- в тригонально-призматичній позиції 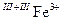 призводить до поглинання короткохвильової частини спектру із зміщенням краю поглинання в зелену область.
призводить до поглинання короткохвильової частини спектру із зміщенням краю поглинання в зелену область.
Наявність у структурі берилу хромофорних центрів 1 і 2 призводить до формування у нього золотисто-жовтого (геліодорового) забарвлення. Переважання над і спричинює оранжево-жовтий відтінок геліодору.
Розміщення Fe2+ і Fe3+ в сусідніх кристалохімічних позиціях, тісно (через ребро чи грань) пов’язаних між собою, призводить до реалізації перенесення заряду в парі Fe2+ і Fe3+ .
Перенесення заряду за схемою відмічається на оптичних спектрах смугою поглинання 12350 см-1 і спричинює аквамаринове (зелено-голубе) забарвлення берилу. Реалізація схеми ↔ призводить по широкої смуги поглинання в червоному діапазоні (~ 14300 см-1) і синьо-фіолетового забарвлення берилу.
|
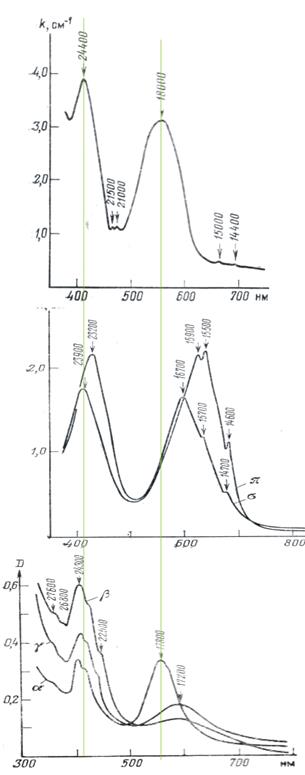
| Рис. 11.38. Спектри поглинання корунду–рубіну (а), берилу–смарагду (б) і хризоберилу–александриту (в), на яких видно смуги кристалічного поля іону Cr3+. Зверніть увагу на зсув смуг поглинання на спектрі берилу стосовно спектру корунду, що зумовлено зменшенням напруги кристалічного поля в октаедричних позиціях берилу. Спектри берилу і хризоберилу, зняті в різних кристалографічних напрямках, відображають виразний ди- і трихроїзм. У смарагду вздовж осі с забарвлення має виразний жовтий тон, тоді як поперек с є зеленим. Опис трихроїзму александриту дивіться у тексті. |
Реалізація в одному кристалі двох схем перенесення заряду: → O2- і ( ↔ ) призводить до поглинання фіолетової так і червоної частини спектру і формування світло-зеленого забарвлення берилу. Саме таке забарвлення є характерним для берилів із камерних гранітних пегматитів Волині (Житомирська область).
На прикладі берилу ми побачили, як один і той же іон, знаходячись в різних кристалохімічних позиціях і у різному оточенні, спричинює реалізацію різних схем перенесення заряду і, відповідно, зміну забарвлення від жовтого через зелене до синьо-фіолетового.
Висновок:
Ідіохроматичне забарвлення ІV типупов’язане із переходами між розщепленими рівнями d–електронів іонів перехідних металів у кристалічному полі.
Це забарвлення пов’язане із спектрами кристалічного поля. Воно характерне для прозорих мінералів, що містять у своєму складі іони перехідних металів Fe2+, Fe3+, Cr3+, V3+, Mn2+, Mn3+, Co2+, Ni2+, Cu2+. Широко поширені в мінералах V5+ і Ti4+ не мають d-електронів і, відповідно, не дають смуг кристалічного поля. Вони беруть участь у перенесенні заряду в ізольованих тетраедричних і октаедричних комплексах.
Спектри кристалічного поля чутливі як до характеристик самого іону перехідного металу, так і ближнього і далекого його оточення в кристалічній структурі мінералу, що виразно відображається у варіаціях забарвлення, створюваного одним хромофором.
Фактори, що контролюють забарвлення, викликане електронними переходами між розщепленими орбіталями катіонів перехідних металів у кристалічному полі, наведені нижче.
Вплив симетрії координаціонного поліедра можна продемонструвати наступним прикладом. Іони Co2+ в октаедричній координації створюють рожеве та червоне забарвлення кальциту і ерітрину Co3[AsO4]2·8H2O, а в тетраедричній – синє забарвлення шпінелі (Mg,Co)Al2O4.
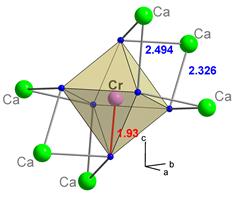
На колірність впливає специфіка хімічного зв’язку між катіоном перехідного металу і аніонами оточення. Розглянемо кольоротвірну дію Cr3+, що ізоморфно входить в позицію Al3+ в таких мінералів як корунд і берил. Структура корунду – найщільніша упаковка аніонів O2- із заповненням 2/3 октаедричних порожнин катіонами Al3+. Структура берилу більш далека від найщільнішої упаковки (див. рис. 11.37) і в ній присутні сильні катіони Be і Si, які понижують електронну щільність (ефективний заряд) O2-, розміщених у вершинах навколо Al3+, що призводить до підвищення ковалентності зв’язків Al–O. Вказані фактори у берилі спричинюють зменшення сили кристалічного поля для катіонів Al3+, порівняно із корундом. Входження Cr3+ в октаедричну позицію Al3+ в обох мінералах супроводжується формуванням різних спектрів розщеплення, залежно від сили кристалічного поля. В сильному кристалічному полі енергія розщеплення є вищою, що призводить до поглинання високоенергетичної частини спектру (фіолетового і жовто-зеленого діапазону) (див. рис. 11.22) і формування густо-червоного, із багряними (синюватими) тонами, забарвлення у рубіну – відміни корунду. Таке забарвлення появляється при вмістах ~ 1 ваг. % Cr2O3 в корунді.
Викривлені октаедричні позиції Al3+ берилу мають дещо слабше кристалізаційне поле – 2,05 еВ порівняно із 2.23 еВ в корунду. Ці, здавалося б незначні, зміни викликають зсув смуги поглинання в довгохвильову область(рис. 11.38), що зумовлює появу в хром-містячого берилу насиченого зеленого із жовтуватими або голубуватими тонами забарвлення. Така відміна берилу називається смарагдом.
|
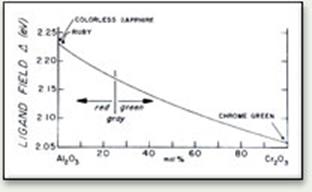
| Рис. 11.311. Зміна напруженості кристалічного поля і забарвлення в ряду твердих розчинів від безбарвного корунду Al2O3 до зеленого оксиду хрому Cr2O3. |
Аналогічне пониження напруженості кристалічного поля спостерігається у корунду при збільшенні вмісту в ньому Cr (рис. 11.39), так як іонність зв’язку Cr–O є меншою, в порівнянні із зв’язком Al–O. Як наслідок, збільшення вмісту Cr в корунді призводить до поступової зміни червоного забарвлення на зелене.
Ми бачимо, що незначні зміни напруженості кристалічного поля викликають разючу зміну забарвлення від рубінового до смарагдового.
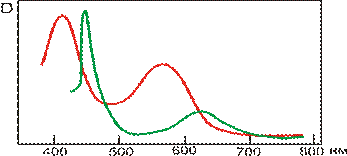
Варто було б очікувати мінерали із проміжною напруженістю кристалічного поля для іонів Cr3+ в октаедричній позиції. Саме таким мінералом є хромистий хризоберил BeAl2O4 – александрит, рідкісний і вартісний ювелірний камінь. Як видно із рис. 11.35в, смуги поглинання, зумовлені розщепленням d-орбіталей Cr3+ в кристалічному полі для корунду і хризоберилу співпадають, міняється тільки співвідношення інтенсивностей поглинання смуг 23700-24000 см-1 і 17800-18000 см-1, що особливо помітно, якщо міняти орієнтацію вектора поляризованого світла E. При цьому, співвідношення інтенсивності поглинання і розміщення смуги в довгохвильовій області змінюється, що зумовлює виразний поліхроїзм александриту: багряний або коричнево-червоний по Np, зеленкувато-жовтий по Nm і яскраво-зелений (смарагдовий) до голубувато-зеленого по Ng.
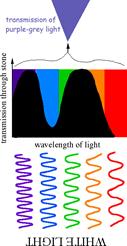
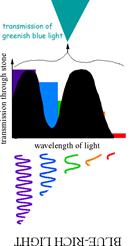
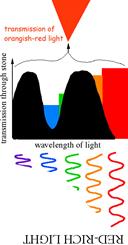
Найбільш чудовою властивістю александриту є його здатність міняти забарвлення залежно від освітлення –денного із білим спектром сонячного світла чи штучного із зміщеним в сторону червоного спектром лампи розжарювання. Цей ефект, що має назву «александритового», зустрічається і в деяких інших мінералів та їх синтетичних аналогів – гранатів, цоізитів, шпінелей, флюориту.
«Александритовий» ефект хризоберилу є наслідком певного розміщення смуг поглинання іону Cr3+ у видимому діапазоні спектру. На спектрі (рис. 11.36в) спостерігаються два «вікна прозорості» в червоному (650-670 нм) і зеленому (490-510 нм) діапазоні. Забарвлення при такій позиції смуг поглинання іонів Cr3+ (або V3+ у цоізиту) є результатом змішування відповідних кольорів, додаткових стосовно один одного. Якщо до зеленого кольору домішувати додатковий, тобто червоний, колір, то результуюче забарвлення буде залишатися зеленим (сіро-зеленим, зеленкувато-сірим), а при певному співвідношенні мінерал стане безбарвним, сіруватим. Подальше збільшення червоної компоненти в суміші приведе до появи відтінків червоного (червонувато-сірий, сірувато-червоний) аж до чисто-червоного. Тому, при денному освітленні, що забезпечує одинакову інтенсивність пропускання в обох «вікнах прозорості», і завдяки підвищеній чутливості людського ока на зелене світло, людина сприймає забарвлення александриту як смарагдово-зелене, а при флюорисцентній лампі – як голубувато-зелене. Якщо ж світло поступає від лампи розжарення або свічки і має, завдяки цьому, більшу інтенсивність червоної частини спектру при майже повній відсутності зеленої складової, то олександрит набуває рубіново-червоного забарвлення.
| 
| 
|
Рис. 11.40. Схема. що пояснює виникнення александритового ефекту.
На забарвлення: що створюється одним і тим же хромофором, впливають також катіони, що знаходяться за межами координаційного поліедру – іони другої координаційної сфери. Характерним прикладом реалізації такого ефекту є кольоротвірна дія іону Cr3+ в октаедричній позиції гранатів піропу Mg3Al2[SiO4]3 і гросуляру Ca3Al2[SiO4]3. Бездомішкові індивіди цих мінералів безбарвні, якщо вони не містять хромофорів. В обох випадках Cr3+ заміщує Al в октаедричній позиції. Однакова концентрація Cr3+ (1-2 ваг. % Cr2O3) у складі піропу спричинює густо-червоне забарвлення, а в ґросулярі – яскраве смарагдово-зелене. Ще більша насиченість зеленого кольору властива уваровіту Ca3Cr2[SiO4]3.
Зміна Mg2+ на більший катіон Ca2+ призводить до «зрихлення» структури, завдяки збільшенню міжіонних віддалей кисню із усіма катіонами, що показано на рис. 11.41.
Так як сила кристалічного поля Dq зменшується із збільшенням віддалі центральний атом – ліганд, це призводить до зниження енергії електронних переходів в іонів Cr3+ і зміщення смуг поглинання в довгохвильову область. Внаслідок цього червоне забарвлення змінюється зеленим. Така зміна може спостерігатися і у піропів, коли частина Mg2+ у восьмерній позиції заміщується на Ca2+. При високих вмістах Ca2+ хром-містні піропи мають зелений колір. Комбінація високих вмістів Ca2+, Cr3+ і Fe спричинює виникнення в піропів «александритового» ефекту.

| 
|
 Піроп Mg3(Al,Cr)2[SiO4]3
Піроп Mg3(Al,Cr)2[SiO4]3
|  Ґросуляр (демантоїд) Ca3(Al,Cr)2[SiO4]3
Ґросуляр (демантоїд) Ca3(Al,Cr)2[SiO4]3
|
 [С1] [С1]
| |

| 
|
| Рис. 11.42. Схема. що ілюструє вплив другої катіонної координаційної сфери на забарвлення гранатів із домішкою Cr3+. Розглядаються два гранати – піроп і ґросуляр, які, при відсутності хромофорів – перехідних металів – є безбарвними (а). структура яких показана на рис. б d-рівні катіонів Cr3+, що входять в октаедричну позицію Al3+ |
Вплив сили кристалічного поля на забарвлення можна також продемонструвати на прикладі зміни характеру заповнення електронами рівнів у розщеплених d–орбіталях в катіонах перехідних металів Fe2+, Mn2+ і Fe3+ у октаедричній координації аніонами О2-. Якщо кристалічне поле слабке, d-електрони будуть прагнути заповнити розщеплені орбіталі eg і t2g таким чином, щоб, згідно правила Гунта, зберегти паралельність спінів. Так як енергія розщеплення для цих катіонів невелика, це легко досягається і електрони залишаються неспареними (див. рис. 11.7). Перехід електронів на частково заповнені рівні eg , що міг би бути спричинений поглинанням квантів світла, є переходом при спіновій забороні, і енергетично невигідний, так як електрони «опираються» зміні орієнтації спіну. Тому смуги поглинання для таких катіонів у видимому спектрі є дуже слабкими. Завдяки цьому, ряд мінералів із слабким кристалічним полем в координаційній сфері цих катіонів є безбарвними або слабо забарвленими. Такими є світлопопелястий тефроїт (Mn-олівін), безбарвні сульфати Fe3+ , карбонати Fe2+ (сидерит, анкерит).
Часто в одному структурному типі зміна хімічного складу призводить до зміни напруженості кристалічного поля. Розглянемо цю залежність на прикладі мінералів із структурою типу олівіну, в якій Fe2+ займає октаедричну позицію.
У сінгаліту (Mg, Fe)Al[BO4] кристалічне поле в позиціях Fe2+O6 є настільки слабке, що електрони частково заповнюють всі рівні, що блокує поглинання світла і зумовлює відсутність забарвлення в мінералу.
Енергія розщеплення в октаедричних позиціях олівіну (ряд твердих розчинів від форстериту Mg2[SiO4] до фаяліту Fe2[SiO4]) є достатньою для розміщення всіх шести d-електронів Fe2+ на трьох t2g–рівнях і , разом з тим, досить малою, такою, що може забезпечити поглинання тільки низькоенергетичних квантів світла для переходу електронів на незаповнені eg –рівні. Результатом цього є смуга поглинання в ближньому ІЧ-діапазоні, короткохвильове «плече» якої попадає в червоний діапазон. Смуга поглинання в УФ-діапазоні зумовлена перенесенням заряду Fe3+↔O2- (іони Fe3+ є домішковими і входять в невеликих кількостях у октаедричні позиції). Довгохвильовий край цієї смуги попадає у фіолетовий діапазон, що забезпечує широке «вікно прозорості» в інтервалі 480-620 нм (рис. 11.41). Результатом є типове для олівінів забарвлення в зеленому тоні від зеленкаво-жовтого форстериту до темного коричнево-зеленого фаяліту. Збільшення вмісту Fe3+ і, відповідно, зростання інтенсивності коротко-хвильового поглинання веде до домінування жовтих та коричневих тонів в олівіну. Збільшення кількості іонів-хромофорів призводить до зниження прозорості при збереженні колірності олівіну.
Аналогічна зміна забарвлення спостерігається у піроксенів ряду діопсид CaMg[Si2O6] – геденбергіт CaFe[Si2O6], у яких колір мінералу змінюється від безбарвного через зелений та коричнево-зелений до чорного по мірі зростання вмісту геденбергітового міналу.
У гранатах альмандині Fe3Al2[SiO4]3 та піропі (Mg,Fe)3Al2[SiO4]3 іони Fe2+ знаходяться у 8-ій координації, що забезпечує сильне кристалізаційне поле. Три широких смуги поглинання знаходяться в коротко-хвильовій частині спектру (рис. 11.38). Виникають два вікна прозорості складної конфігурації – у синьо-фіолетовому (400-4500 нм) та червоному (600-700 нм) діапазонах. Зміна співвідношення пропускання та ширини цих вікон залежать від складу четверного твердого розчину альмандин-піроп-спесартин-гросуляр та від вмісту інших хромофорів (зокрема Fe3+6 так як перенесення заряду Fe3+↔O2- відповідальне за короткохвильовий край поглинання). Відповідно, забарвлення може змінюватися як за тоном – від оранжево-червоного і рожево-червоного до червоного і фіолетово-червоного (багряного), так і за насиченістю та світлістю в достатньо широких межах.
Виразне рожево-червоне забарвлення евдіаліту, спричинене знаходженням Fe2+ в п’ятерній (пірамідальній) координації.
Інший тип спектрів поглинання характерний для іонів Fe2+ в тетраедричних позиціях шпінелі (Mg,Fe2+)Al2O4. Спектр характеризується серією вузьких смуг поглинання у видимому діапазоні і краю УФ-області. Ці смуги пов’язують із спін-забороненими d–d- переходами між розщепленими рівнями IVFe2+. Фіолетовий тон забарвлення, що виникає при цьому, зумовлений наявністю двох вузьких вікон пропускання в області 400-530 нм , розділених дуплетною смугою поглинання 22000–21000 см-1. Вікно у червоном діапазоні забезпечує виникнення «александритового ефекту» у фіолетових шпінелей. На денному світлі вони фіолетові, при штучному освітленні (лампою розжарювання) – мають червоні і багряні тони.
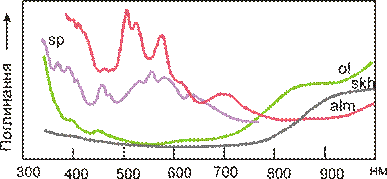
| Рис. 11.41. Спектри кристалізаційного поля іону Fe2+ для мінералів із різним забарвленням: ol – жовтаво-зелений олівін; alm – рожево-червоний альмандин; sp - фіолетова шпінель, skh – безбарвний сінгаліт. |
Зміна координації та локальної симетрії іону Fe2+ в лігандному оточенні киснем веде зміни забарвлення мінералів у широких межах. Для більшості силікатів VIFe2+ є типовим хромофором, що створює забарвлення від жовто-зеленого до коричнево-зеленого. Поряд із цим, входження Fe2+ в позиції із іншою координацією може викликати забарвлення в рожевих, фіолетових тонах.
Розглянемо вплив кристалічного поля на кольоротвірні здатності іншого поширеного хромофору – іону трьохвалентного заліза. Входження Fe3+ в склад оксидів та оксисолей є важливим кольоротвірним фактором як завдяки інтенсивному поглинанню, зумовленому перенесенням заряду Fe3+ ↔ O2-, так і спектрами кристалічного поля, що накладаються на плече краю короткохвильового поглинання. Ці причини зумовлюють два основних колірних тони – жовто-зелений і коричневий, а також різке зниження інтенсивності пропускання при збільшенні вмісту Fe3+, внаслідок чого мінерали стають коричнево-зеленими, темно-коричневими, або ж чорними.
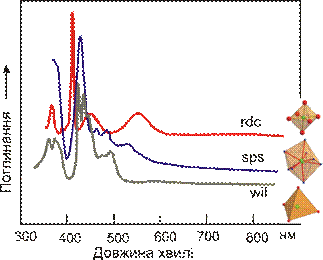
Хризоберил BeAl2O4 має структуру, похідну від шпінелі, і тому октаедричній позиції Al3+ характеризуються сильним кристалічним полем. Входження в ці позиції Fe3+, викликає сильне розщеплення п’яти d-орбіталей, що проявляється у чотирьох вузьких смугах поглинання, що накладаються на короткохвильовий край поглинання, зумовлений перенесенням заряду Fe3+↔O2 (рис. 11.42). Поглинання в червоному діапазоні спектру відсутнє. Колір безхромового хризоберилу змінюється від жовтого, зеленувато-жовтого до коричнево-жовтого по мірі зростання вмісту Fe3+ в його складі. Виразний плеохроїзм Fe-хризоберилу пов’язаний із пониженням локальної симетрії поліедрів Fe3+O6, що спричинює енергетичні відмінності в перенесенні заряду у різних напрямках.
Аналогічну природу зелений тон забарвлення гранатів ряду твердих розчинів ґросуляр–андрадит (ґрандитів) Ca3(Al,Fe3+)2[SiO4]3. також містить VIFe3+ , тільки в дещо іншому оточенні. Іони Fe3+ координовані атомами кисню, але на відміну від хризоберилу, що є оксидом, у силікату андрадиту кожен атом кисню пов’язаний ще із атомами Si. Внаслідок цього досягається більш тонке розщеплення електронних орбіталей і відповідно, встановлюються нижчі значення енергії розщеплення. це призводить до виникнення вузького вікна пропускання в синьо-фіолетовій області (405–435 нм). Збільшення вмісту андрадитового міналу призводить до зміни світло-зеленого забарвлення коричнево-зеленим і темно-коричневим. Причиною жовтих і оранжевих тонів у гесоніту (відміни грандиту) є входження Fe3+ в тетраедричній позиції при ізоморфізмі Si4+ → Fe3+. Це призводить до зміщення краю поглинання в довгохвильову область внаслідок перенесення заряду IVFe3+ ↔ O2- і додаткових смуг поглинання d–d-переходів, що накладаються на спектр іонів VIFe3+ (див. рис. 11.42, спектр 3).
|
| Рис. 11.42. Спектри кристалізаційного поля іону Fe3+ для мінералів із різним забарвленням: 1 – жовто-зелений хризоберил, інтенсивність забарвлення якого залежить від напрямку проходження світла (α – Np, β – Nm, γ - Ng); 2 – світло-зелений грандит (тверий розчин ґросуляр-андрадит); 3 – оранжево-жовтий гесоніт (відміна ґрандиту). |
Важливими хромофорами, кольоротвірний вплив яких пов’язаний із спектрами кристалічного поля, є іони мангану Mn2+ і Mn3+. Іони Mn4+ зустрічаються тільки в оксидах і викликають майже повне поглинання світла в широкому діапазоні, зумовлене смугами перенесення заряду і вузькою забороненою зоною. Виразне забарвлення проявляється тільки при входженні Mn2+ або Mn3+ в ізольовані октаедричні або тетраедричні позиції в оксисолях (силікатах, карбонатах, фосфатах і т.п.).
Іони Mn2+ у прозорих мінералах можуть знаходитися в оточенні кисню в октаедричній і тетраедричній координаціях. В слабкому кристалічному полі стабільною є високо спінова конфігурація d5- іону Mn2+, при якій можливі тільки заборонені по спіну переходи, що зумовлюють слабке забарвлення навіть при високій концентрації хромофору. Такою є октаедрична позиція Mn2+ в манганистому олівіні – тефроїті. Зростання сили кристалічного поля зумовлює перехід у низько спінову конфігурацію із одним неспареним електроном і дозволом на d-d –переходи. Для мінералів із такими кристалохімічними позиціями Mn2+ характерні декілька смуг із високими молярними коефіцієнтами поглинання, що зумовлює виразне забарвлення.
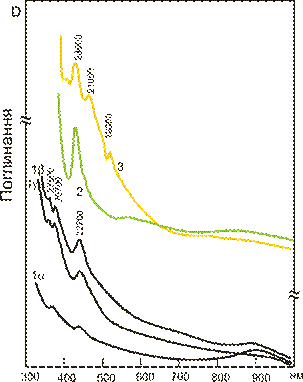
Родохрозит Mn[CO3] характеризується трьома вузькими смугами поглинання (рис. 11.43) у видимій області спектру (найбільш інтенсивною є смуга 24000 см-1) і рожево-червоний колірний тон забарвлення. Насиченість забарвлення сильно залежить від складу твердого розчину кальцит-сидерит-магнезит, так як ефективність хромофору VIMn2+ є невеликою, тільки велика його концентрація дає насичений колір. Зменшення його вмісту зумовлює перехід до блідо-рожевих відмін родохрозиту. Аналогічний колірний тон характерний для родоніту CaMn4[Si5O15], бустаміту (Mn,Ca)3[Si3O9], серандиту (Mn,Ca)2NaH[Si3O9], кристалогідратів сульфатів Mn2+. Рожево-червоне забарвлення, створюване Mn2+ інтенсивно «гаситься» іншими хромофорами, зокрема іонами заліза, що виразно проявляється у варіаціях забарвлення від сіро-рожевого до темно-коричневого у манганових мінералів, що формують тверді розчини із Fe-міналами, таких як літіофіліт Li(Mn,Fe)[PO4] і трифілін (Mn,Fe)2F[PO4].
У структурі гранату спесартину Mn2+ знаходиться у викривленій восьменній координації, що викликає зміщення краю короткохвильового поглинання в синю область і, відповідно, появу в мінералу оранжевого або жовто-оранжевого забарвлення.
 rdc
rdc
|  sps
sps
|  wil
wil
| |
| Рис. 11.43. Спектри кристалізаційного поля іону Mn2+ для мінералів із різним забарвленням: rdc – рожево-червоний родохрозит; sps – оранжевий спесартин; wil – яскраво-жовтий вілеміт. Поряд із лініями спектрів показано форму координаційного поліедру позиції із Mn2+. | ||
У вілеміту Zn2[SiO4] домішкові іони Mn2+ входять у тетраедричну позицію цинку, сильне кристалічне поле якої зумовлює низько спінову електронну конфігурацію і появу численних вузьких смуг поглинання в короткохвильовому видимому діапазоні із вузьким вікном прозорості у фіолетовому діапазоні. Всі ці фактори зумовлюють яскраво-жовте до червонуватого забарвлення мінералу.
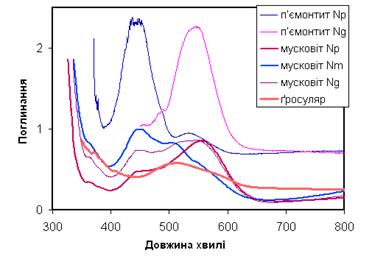
| Рис. 11.44. Спектри кристалізаційного поля іону Mn3+ для мінералів із різним забарвленням: вишнево-червоний п’ємонтит, червоно-багряний мусковіт Minas Gerais, Brazil, alurgite variety, малиново-червоний ґросуляр |
Іон Mn3+ є нестабільним і легко переходить в Mn 4+ або ж Mn2+, залежно від окисно-відновних умов. В природі він може стабілізуватися кристалічним полем мінералу, але і в цьому випадку він займає тільки певні кристалохімічні позиції, конкуруючи із іншими іонами мангану. які характеризуються більш сприятливими енергетичними параметрами. Відомо, що іон Mn4+ має найбільшу енергію стабілізації кристалічним полем, а високо
|
|
| 
|
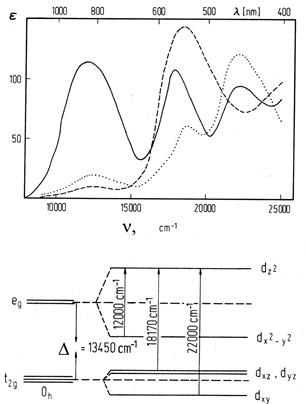
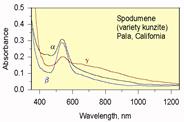
| Рис. 11.45. Спектри поглинання іону Mn3+ в п’ємонтиті (зліва) (за Burns, 1970) і сподумені (кунциті) (справа) (за А.П.Платоновим, 1984) і схема будови енергетичних рівнів Mn3+ в октаедричному кристалічному полі із показом електронних переходів, що викликають смуги поглинання на спектрі. На верхньому рисунку показані спектри, зняті при проходженні світла в різних кристалографічних напрямах: суцільна лінія – паралельно b; крапкова – під кутом 5° до осі c; пунктирна – під кутом 30° до осі c. |
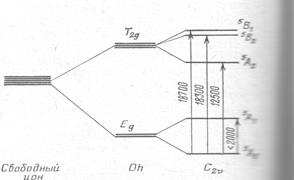
спінова конфігурація Mn2+ є найбільш стійкою. Тільки в сильному октаедричному кристалічному полі і при значному викривленні координаційного поліедру, яке спричинює пониження виродження основного стану , а відповідно – пониження енергії іону, Mn3+ стає відносно стабільним. В таких позиціях розщеплення електронних орбіталей d4-конфігурації Mn3+ (див. рис. 11.23) фрагментується завдяки ефекту Яна-Телера, що призводить до появи двох широких смуг поглинання (22 000 см-1 і 18 000 см-1) на оптичних спектрах (рис. 11.44). Поглинання у фіолетовому і зеленому діапазонах викликає забарвлення в червоних і рожево-червоних тонах. Інтенсивність поглинання для кожної із цих смуг виразно залежить від кристалографічної орієнтації, що проявляється у виразному плеохроїзмі більшості мінералів із VIMn3+. Це можна простежити на спектрах розповсюдженого вишнево-червоного п’ємонтиту (із роду епідоту) і рідкісного малиново-червоного мусковіту (алурґіту) із родовищ Мінас Жерайс в Бразилії (рис. 11.44). Таку ж природу має темно-червоне забарвлення пурпуриту (Mn, Fe) [PO4] та червоно-коричневе – манганистого флогопіту K(Mg,Mn)(0H, F2)[AlSi3O10], малиново-червоного ґросуляру.
В багатьох силікатах можуть бути присутні обидва іони – Mn2+ і Mn3+. Як було сказано вище, кристалізаційне поле більшості октаедричних позицій є заслабким для формування низькоспінової електронної конфігурації Mn2+ і тому цей іон не впливає на формування забарвлення. Доказом цього є відсутність кореляції між інтенсивностю кольору і сумарним вмістом Mn в багатьох мінералах. Характерним прикладом цього є турмаліни. Манган-містячі турмаліни часто мають рожеве та червоно-рожеве забарвлення; такі відміни називаються рубелітами. Доказано, що хромофором у цьому випадку є VIMn3+. Поряд із цим, високі концентрації Mn встановлені у безбарвному турмаліні – ахроїті, але в цьому випадку ці концентрації є результатом входженням Mn2+ в октаедричні позиції Al.
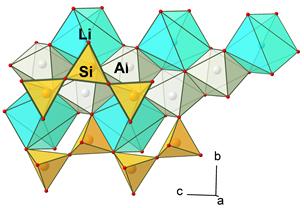
Інший можливий варіант – у мінералі існує декілька типів кристалохімічних позицій, що можуть приймати Mn3+ і відрізняються міжатомними віддалями та локальною симетрією лігандного оточення. Відмінності в кристлічному полі зумовлюють те, що один і той же хромофор в різних позиціях створює різний колірний тон, що спричинює широкі варіації забарвлення. Прикладом такої ситуації є Mn-містячий літієвий піроксен – сподумен. Структура сподумену містить дві октаедричні позиції (рис. 11.45):
1. позицію M1 – менший і слабо викривлений октаедр, звичайно заселену Al3+;
2. позицію M2 – більший сильно викривлений шестивершинник, звичайно заселений Li+.
Обидві ці позиції можуть заселятися як Mn3+, так і Mn2+. Для Mn3+ більш стабільною є позиція M1 (схема ізоморфізму Al3+ → Mn3+); Mn2+ входить в позицію M2 за схемою 2Li+ → Mn2+ + ð або ж в обидві позиції за схемою Al3+ + Li+ → 2Mn2+. Залежно від зайнятої позиції, міняється кольоротвірна дія іонів. Mn3+ в позиції M1 дає рожеве до бузкового забарвлення, а в позиції M2 – світло-зелене, тоді як Mn2+ в цих позиціях не є кольоротвірним. Характер заселення кристалохімічних позицій залежить від фізико-хімічних умов середовища росту індивідів сподумену, таких як активність Li+ та Al3+ , окисно-відновний потенціал. Коливання цих параметрів спричинюють ріст зональних за забарвленням сподуменів – кунцитів із зміною забарвлення від бузкового різної густоти, яскраво-рожевого через блакитно-бузкові, сірувато-сині до блідо-зелених або безбарвних. У всіх цих випадках хромофор один – Mn3+; змінюється тільки його концентрація і кристалохімічні позиція. При входженні інших хромофорів у структуру сподумену можливе забарвлення інших колірних тонів, зумовлене поглинанням кристалічного поля: Cr3+ в позиції M1 дає зелене забарвлення (відміна гіденіт), Fe3+ в позиції M1 – жовто-зелене бліде забарвлення трифану.
Висновок:
Забарвлення V типу, зумовлене переходами між рівнями f-електронів рідкісних земель і актиноїдів.
| 
|
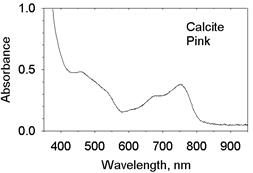
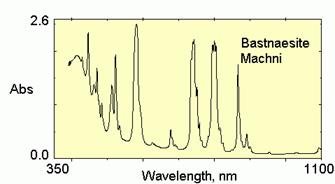
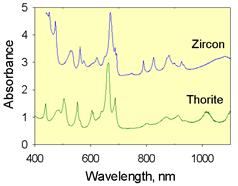
| Рис. 11.46. Спектри поглинання мінералів із забарвленням V типу а) оранжево-коричневий бастнезит Ce[CO3]F із Machni коло Warsak Dam, Пакистан, забарвлення зумовлене спектрами кристалічного поля рідкісних земель REE3+; б) зелений торит і жовто-зелений циркон, забарвлення яких зумовлене спектром кристалічного поля U4+; в) рожевий кальцит із домішками Eu2+ |
Кольороформуюча роль смуг поглинання кристалічного поля інших хромофорів може бути оцінена за таблицею 11.11.
Ідіохроматичне забарвлення V типу – забарвлення,зумовлене переходами між рівнями f-електронів рідкісних земель і актиноїдів. Виділяють три підтипи:
а) забарвлення, зумовлене переходами в межах fk-конфігурацій – TR3+, U4+, U3+, U2+; спектри їх складені численними вузькими слабкими лініями, дають дуже слабке забарвлення. Забарвлення монациту, аланіту, титаніту (додаткові смуги в червоному діапазоні), баснезиту, циркону. ториту
б) б) забарвлення, зумовлене переходами 4 fkà4 fk-15d, тобто переходами на рівні змішаної fd- конфігурації; із ними пов’язані широкі смуги поглинання, що викликають забарвлення сполук Eu2+. Одиноким природним прикладом є рожеве забарвлення кальциту із домішкою Eu2+.
Ідіохроматичне забарвлення VІ типупов’язане із електронно-дірковими центрами, молекулярними іонами, вільними радикалами. Це забарвлення так само зумовлене селективним поглинанням у видимому діапазоні спектру електромагнітного випромінювання внаслідок взаємодії фотонів світла із неспареними електронами. Відмінність полягає тільки в тому, що ці електрони не «прив’язані» до певних компонентів структури – до певного іону чи молекулярної орбіталі, а є «власністю» дефекту структури. Само собою, тип дефекту, його будова повністю залежать від вміщуючої кристалічної структури. Кожний мінерал має властивий тільки йому набір дефектів та електронно-діркових центрів (ЕДЦ). Ступінь поширення ЕДЦ в мінералі та співвідношення різних їх типів визначається умовами росту мінералу та геологічними обставинами, в яких він перебував.
Таблиця 11.10. Приклади ідіохроматичного забарвлення мінералів, викликаного смугами поглинання кристалічного поля іонів перехідних металів, лантаноїдів та актиноїдів.
| Хромофори | КЧ | Мінерал (забарвлена відміна) | Формула | Колір у сонячному світлі |
| Cr3+ | корунд (рубін) | (Al,Cr)2O3 | багряно-червоний | |
| шпінель | Mg(Al,Cr)2O4 | рожевий, червоний | ||
| клінохлор | бузковий | |||
| топаз | (Al,Cr)2[SiO4](OH,F)2 | бузковий, фіолетовий | ||
| берил смарагд | зелений | |||
| уваровіт | зелений | |||
| хризоберил | зелений | |||
| Mn2+ | спесартин | рожевий, жовтий | ||
| родохрозит | рожево-червоний | |||
| родоніт | рожевий | |||
| Вілеміт | жовто-зелений | |||
| апатит | густо-фіолетовий | |||
| Mn3+ | Андалузит | зелений | ||
| Тремоліт | фіолетовий | |||
| П’ємонтит | червоний | |||
| мусковіт | червоний | |||
| берил (морганіт) | червоний | |||
| Fe2+ | альмандин | рожевий | ||
| форстерит (хризоліт) | жовто-зелений | |||
| фаяліт | коричневий | |||
| дравіт | жовто-коричневий | |||
| шерл | чорний | |||
| біотит | коричнево-зелений | |||
| корунд | зелений | |||
| 4кв | гілеспіт | BaFe[Si4O10] | малиново-рожевий | |
| 4 кв | евдіаліт | {Na12Ca6Fe2+3Zr3[Si3O9] [Si9O27]2}· Na<4OH<4 | малиново-рожевий | |
| Fe3+ | андрадит | темно-коричневий | ||
| Гросуляр | жовто-зелений | |||
| корунд | (Al,Fe)2O3 | жовтий | ||
| Кок’юмбіт | Fe3+2 [SO4]3·9H2O | блідо-багряний | ||
| стрінгіт | Fe3+ [PO4]·2H2O | блідо-багряний | ||
| Плагіоклаз | блідо-жовтий | |||
| Діопсид | жовто-оранжевий | |||
| Cu2+ | діоптаз | зелений | ||
| 4(?) | бірюза | блакитний | ||
| 4кв | азурит | синій | ||
| малахіт | зелений |
Таблиця 11.10. Приклади ідіохроматичного забарвлення мінералів, викликаного смугами поглинання кристалічного поля іонів перехідних металів, лантаноїдів та актиноїдів.
| Збудники забарвлення | КЧ | Мінерал (забарвлена відміна) | Формула | Колір |
| V3+ | гросуляр (тсаворит) | зелений | ||
| цоізит танзаніт | синій óрожевий | |||
| Co2+ | шпінель | (Mg,Co)Al2O4 | блакитний | |
| еритрин | Рожево-червоний | |||
| кальцит | рожевий | |||
| Ni2+ | Форстерит | зелений | ||
| кальцит | Цитриново-жовтий | |||
| анабергіт | зелений | |||
| смектит(волинськіт) | Зелений | |||
| REE3+ (Ce, Yt, Nd, Eu, ) | кальцит | рожевий | ||
| монацит | Оранжево-коричневий | |||
| Ce-бастнезит | CeF[CO3] | Оранжево-коричневий | ||
| Ce-паризит | Ce2CaF2[CO3]3 | Жовто-коричневий | ||
| аланіт | Оранжево-коричневий | |||
| U4+ | торит | Зеленкувато-жовтий | ||
| циркон | Зеленкувато-жовтий |
Природа електронно-діркових центрів описана в розділі 9. Дефекти різних типів викликають локальне порушення балансу заряду в структурі і тому є «пастками» для електронів чи «дірок». Якщо електрон захоплений аніонною вакансією, то така ділянка в структурі називається електронним центром забарвлення. Якщо аніон або аніонний комплекс віддає один електрон із існуючої електронної пари, і, як наслідок, в цій ділянці залишається неспарений електрон, тоді ця ділянка може захоплювати дірку, збільшуючи таким чином додатній заряд в структурі. Така ділянка в структурі називається дірковим центром забарвлення. Звичайно електронно-діркові центри поглинають низькоенергетичну – червону – частину спектру, що спричинює зростання частки зеленої та синьої складових кольору.
Передумовою виникнення більшості ЕДЦ є явища гетеровалентного ізоморфізму в ході росту мінералу. Реалізація в мінералі механізму селективного поглинання світла, пов’язаного із електронними переходами в ЕДЦ пов’язане із двома явищами, що діють у протилежних напрямках:
1. Високоенергетичні частинки, створені в результаті природних радіоактивних процесів, взаємодіють із електронами, спричинюючи їх переміщення і виникнення електронних чи діркових центрів на місці домішкових прекурсорів або поряд із ними.
2. Теплові події в історії мінералу (періоди нагрівання як результат магматизму чи метаморфізму) підсилюють теплові коливання атомів у вузлах кристалічної гратки і взаємну анігіляцію чи руйнування ЕДЦ. Часто аналогічний ефект спостерігається при тривалому освітленні мінералу сонячним світлом (вигорання забарвлення на світлі).
Кожний ЕДЦ має свій температурний інтервал стійкості, перевищення температури призводить до руйнування – відпалу ЕДЦ і зникнення зумовленого ним забарвлення. Високоенергетичне опромінення мінералу (гама-промені, рентгенівське, деколи ультрафіолетове випромінювання) призводить до відновлення ЕДЦ і появи в мінералу забарвлення. Саме завдяки здатності до відновлення забарвлення під впливом радіації (високо енергетичного випромінювання) такий тип забарвлення називається радіаційним.
Механізм формування радіаційного забарвлення детально вивчений у невеликої кількості мінералів: кварцу, флюориту, апатиту, сфалериту, кальциту, каркасних алюмосилікатів, галіту. Існує декілька типів ЕДЦ, що можуть викликати забарвлення в мінералів. Такими є:
а) центри, зумовлені домішковими катіонами з d1- конфігурацією (Ti3+, V4+, Nb4+) та з s1, p1 , p5- конфігураціями (Pb, Pb3+)
б) забарвленн зв’язане з O- і молекулярними іонами O2-, S2-, та інш.
в) забарвлення пов’язане із вільними радикалами SO4-, SO3-, та інш.
г) забарвлення, зв’язане із F–, V–центрами та F–агрегатними центрами.
Розглянемо декілька типових ситуацій.
Радіаційне забарвлення кварцу пов’язане із прекурсорами, що створюються в результаті гетеровалентного ізоморфізму в тетраедричній позиції Si4+. Виникнення центрів пов’язане із ізоморфізмом типу Si4+à Al3+ і Si4+à Fe3+.
Розглянемо дірковий центрAl3+-O–-Si4+ в кварцу, що утворюється при входженні алюмінію в позицію кремнію за рахунок втрати одного електрону мостиковим атомом кисню.Дірковий центр є нестабільним і при зміні параметрів (T) захоплює електрон, перетворюючись в O2-.
Наявність діркових центрів зумовлює появу димчастого забарвлення у кварцу. Компенсація надлишкового від’ємного заряду, що виникає при цьому, здійснюється через входження в структуру катіонів лужних металів або H+. Така асоціація є нестійкою і не викликає забарвлення, так як в структурі немає неспарених електронів. Під впливом іонізуючого випромінювання (природнього чи штучного) один із двох спарених електронів аніонів O2-, котрі розміщені по сусідству із Al3+, і тому відчувають деякий дефіцит додатнього заряду, може бути «вибитий»
O2- à O– + e+
Таким чином виникає дірковий центр O–, що містить один неспарений електрон, що може поглинути квант світла і перейти у більш енергетичну позицію. Дисбаланс заряду в межах тетраедру зникає; компенсуючі одновалентні катіони стають непотрібними і дифундують за межі кварцу. O––Al Це і спричинює димчасте забарвлення кварцу – моріону чи раухтопазу.
Якщо електрон «вибитий» в іону кисню, захоплюєіться компенсаційними катіонами, виникає центр O––Al + H0(або Li0), то виникає золотисто-цитринове нестійке забарвлення, що швидко (до 1-2 років) вигорає (внаслідок руйнування центру) на сонячному світлі) і стійке тільки до 200-220°С
Аналогічним чином виникає аметистове у кварцу, пов’язане із прекурсорами, що виникають при входженні в структуру Fe3+. Воно реалізується за декітлькома схемами із ізоморфізмом Si4+à Fe3+. Але забарвлення викликане не іоном Fe3+, а пов’язане із нього центром (FeO44-).
Електронні центри в кварцу виникають при заміщенні Si4+ на Ti4+. Відмінність між ядерними зарядами та екрануванням ядра електронними оболонками дозволяє домішковим атомам захоплювати електрони. Тому при заміщенні Si4+ àTi4+ формується електронний центр (парамагнітний на місці діамагнетного) (Ti4+ + e- = Ti3+). Такі центри стабілізуються входженням компенсаторів - одновалентних лужних катонів (Na+, K+, Li+) в канали структури кварцу безпосередньо поблизу дефектних тетраедрів [Ti3+O4].
Радіаційне забарвлення польових шпатів
Для мікрокліну із зеленим забарвленням (амазоніту) характерним є ізоморфне заміщення K+à Pb2+. В структурі з’являється локальний надлишковий додатній заряд, що стимулює захоплення Pb2+ електрону із формуванням електронного центру Pb+ із неспареним електроном.
Pb2+ + e- à Pb+
Внаслідок цього міняється спектр поглинання мікрокліну і виникає характерне зелене забарвлення амазоніту.
Радіаційне забарвлення содалітів
 а
а
|  б б
| |
 в
в
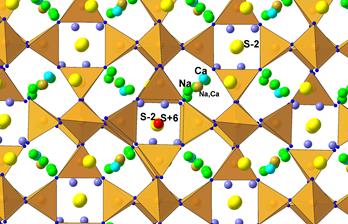
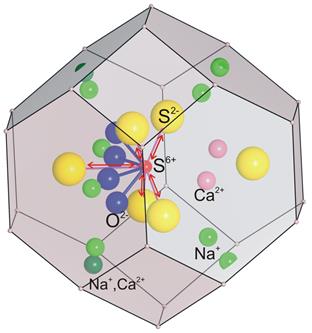
| Рис. 11.47. Кристалічна структура лазуриту поліедричному (а) і SBU-варіантах (б), будова катіонно-аніонного комплексу в порожнині каркасу та схема реалізації перенесення заряду S6+↔S2- (червоні стрілки) аніонних комплексах (в). | |
Специфічною є ситуація, що існує в структурі лазуриту, що належить до каркасних силікатів із формулою алюмосилікатного каркасу [AlSiO4]6 та ізометричними порожнинами, що містять катіонно-аніонний комплекс {Na6(Na,Ca)2[(SO4),S,Cl, (OH)]2}(рис. 11.33). Будова катіоно-аніонного комплексу в порожнинах каркасу (рис. 11.33в) є складною. Він містить два типи іонів сірки (S2- і S6+) у різних співвідношеннях, звичайно близьких 2:1. Віддаль між S2- і S6+ коливається (залежно від кристалохімічної позиції S2-) від 2,24 до 2,42 Å, що створює умов для поглинання довгохвильової частини спектру внаслідок перенесення заряду в таких молекулярних орбіталях [Nassau, 1982]. Наслідком цього є поява у лазуриту насиченого і стійкого синього забарвлення із зміною відтінків від фіолетово-синього до зеленкувато-синього, залежно від складу мінералу. Зміна забарвлення може змінювати як через зміну співвідношення S2-/S6+, так і за рахунок входження в позицію сульфідної сірки інших аніонних груп (Cl-, OH-).
Радіаційне забарвлення флюоритів
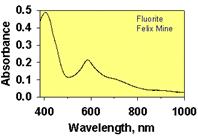
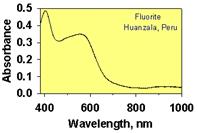
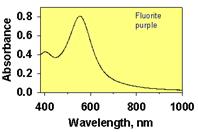
Вакаксія F- в структурі флюориту може виникнути під час росту (сильне перенасичення розчину кальцієм, сильне постійне електричне поле і т.п.) або ж під дією іонізуючого випромінювання, що викликає зміщення іонів фтору в міжвузловий простір. Внаслідок захоплення неспареного електрону таким ефектом, виникає електронний центр (F-центр, від нім. – farben – фарбуючий). Електрон F-центру може змінювати свій енергетичний стан під дією світлових променів, викликаючи появу у флюориту характерного фіолетово-червоного забарвлення (рис. )
Центри колірності флюориту зумовлені активаційними та електронно-дирковими F-центрами, що виникають при гетеровалентному ізоморфізмі (детальніше див. розділ 3.4.6)
| 
| 
|
| Зелений за рахунок формування активаційного Sm2+ -центру під впливом радіоактивного випромінювання на ізоморфний Sm3+ | Рожевий пов’язана із електронно-дирковим (Y3++ O23-)0- центром, що виник внаслідок спарення іонів O2- і O-, що захопили дирку (O23-) | Фіолетово-червоний зумовлений одинарною або спареною вакансією F-,що захопила електрон. |
Рис. 11.48.
· Галіт, безколірний за своєю природою може набувати голубого, до синього кольору при входженні в структуру радіоактивних K40, Rb87
Радіаційне забарвлення зумовлене електронно-дірковими центрами є нестійким і може зникати при тривалому впливі сонячного світла, ультрафіолетового та рентгенівського випромінювання, радіоактивного опромінення, нагрівання. Всі ці впливи призводять до анігіляції дефектів або ж релаксації діркових центрів. Позбавляючись неспарених електронів, F-центри перестають бути кольоротворними.
Склад і кількісне співвідношення домішок зумовлюється із одного боку особливостями кристалічної структури, з другої – умовами формування. Зміна умов формування мінералів у цьому випадку викликає специфічне забарвлення мінералу, відібраного із різних місць геологічного об’єкту, а також в межах одного мінерального індивіду. Домішкове забарвлення мінералу є ненадійною діагностичною ознакою мінералу, зате може слугувати непоганим орієнтиром в оцінці умов його формування та економічних параметрів рудного тіла чи родовища. Домішкове забарвлення є типоморфною ознакою мінералів.
Топаз – голубий та рожевий в залежності від оточення атому Ti3+ : Ti-O4F2 vs TiO4(OH)2
Таблиця 11.12. Причини радіаційного забарвлення мінералів (за Нассау, 1978, із доповненнями)
| Стабільні до T°С | |||
| Електронний центр Pb+ | Мікроклін (амазоніт) | Зелений до синьо-зеленого | |
| Дірковий центр Pb3+ | Кальцит | рожевий | |
| Дірковий центр AlO44- (Al3+–O–) | Кварц Раух-топаз | Коричневий | ~300 |
| Al3+–O– – (Li+ + H+) | Кварц (цитрин) | Жовто-коричневий (цитриновий) | ~180 |
| Вакансія Fe3+–O- | Кварц Аметист | Фіолетовий | 450-500 |
| Вакансія Cr3+-O- | Топаз | Жовтий до червоного | |
| Ti4+ | Корунд | рожевий | |
| Ti3+-Li+ | Кварц | рожевий | ~200-300 |
| Центр F (вакансія OH) | Топаз | жовтий | |
| Центр F (вакансія F) | Топаз | рожевий | |
| Центр Ti-O4F2 | Топаз | блакитний | |
| R-центр (пара аніонних вакансій із захопленими електронами) | Топаз | блакитний | |
| Центр F + R | Топаз | зелений | |
| Центр O-(SiO3-) | Апатит | Зелений | |
| Центр O-(SiO3-) | Циркон | Жовтий, медово-жовтий до бурого | |
| Y3+ – O3-2 | Циркон | рожевий | |
| апатит | рожевий | ||
| флюорит | фіолетовий | ||
| Центр SO3- | блакитний |
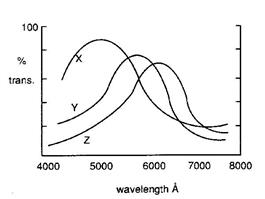
Плеохроїзм – селективне поглинання змінюється в залежності від напрямку проходження світла через кристал, зміна кольору в різних кристалографічних напрямках.

| 
|
| Рис. 11.411. Схема виникнення плеохроїзму в мінералі внаслідок поглинання в різних діапазонах в різних напрямках (X,Y,Z) The purple-orange dichroism (Cr3+ ligand-field colors) in a 3-cm-diameter synthetic ruby; the arrows indicate the electric vectors of the polarizers |
| 
|
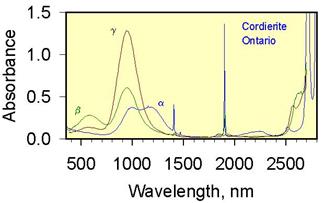
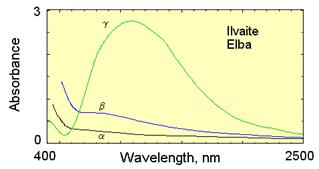
| Рис. 11.50. Плеохроїзм кордієриту і ільваїту |
Приклади: кордієрит (дихроїт), рубін, танзаніт
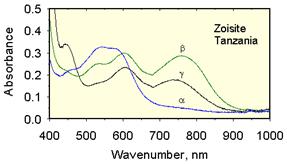
| 
|
| Рис. 11.51.Дихроїзм танзаніту – V–містячого цоїзиту Ca2Al3O(OH)[SiO4][Si2O7], що має фіолетово-синій або рожево-багряний колір в залежності від напрямку проходження світла |
Використання при граненні мінералів – дорогоцінних каменів.
Дата добавления: 2015-05-21; просмотров: 1840;
