Ідіохроматичне забарвлення мінералів.
Ідіохроматичне забарвлення зумовлене кристалохімічними особливостями і хімічним складом мінералу і його невід’ємною властивістю. Воно може спостерігатися в непрозорих, напівпрозорих і прозорих мінералів. Причому, потрібно пам’ятати і розуміти, що ідіоморфне забарвлення мінералу формується багатьма факторами: кристалічна структура сворює передумови реалізації певних механнізмів селективного поглинання у видимому спектрі, а варіації складу твердих розчинів, чи зміна вмісту домішкових компонентів є ключовими для вибору домінуючого із них.
Можна виділити мінерали, особливості структури чи хімічного складу яких створюють можливість постійної реалізації певного механізму поглинання. Такі мінерали мають постійне ідіохроматичне забарвлення із стабільним колірним тоном. Зміна вмісту домішок викликає тільки зміну насиченості та світлості, або ж появу додаткових відтінків, що накладаються на основний тон. Такими звичайно є непрозорі (пірит, халькопірит, борніт, нікелін) та напівпрозорі (кіновар, піраргірит, реальгар) мінерали, а також прозорі мінерали, в яких перехідні метали є мінералоутворюючими (гематит, діоптаз, малахіт) або ж особливості структури створюють ситуацію, сприятливу для постійного існування в структурі вільних радикалів (лазурит).
Поряд із цим, широко поширеними є прозорі мінерали-тверді розчини, що мають змінне ідіохроматичне забарвлення, від безбарвних до забарвлених із зміною світлості (кліноцоїзит-епідот) чи колірного тону (гранати ряду гросуляр-андрадит, турмаліни, флюорит). Зміна забарвлення цих мінералів зумовлена зміною складу твердих розчинів із широкою областю гомогенності, або ж входженням домішок, що сприяють виникненню електронно-діркових дефектних центрів в кристалічній структурі. Основні механізми селективного поглинання видимого світла. що призводять до виникнення забарвлення мінералу і особливості спектрів поглинання для кожного із них показані на рис. 11.30.
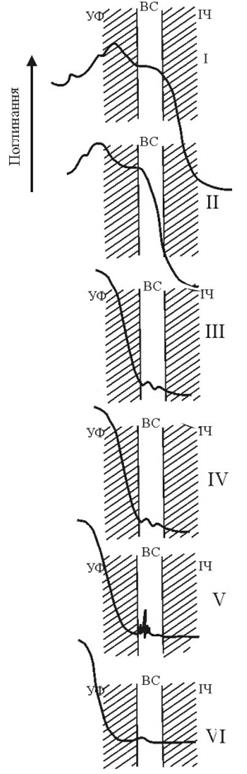
| І. Забарвлення, пов’язане із власним поглинанням, тобто із міжзонними переходами, коли спектр власного поглинання перекриває видиму область. Таку природу має забарвлення непрозорих мінералів із зеркальним відбиттям (металічним блиском). |
| ІІ. Забарвлення, пов’язане із попаданням краю власного поглинання у видиму область. Воно проявляється у мінералів, ширина забороненої зони яких відповідає енергії видимої частини спектру (~ 3–1.6 еВ). | |
| ІІІ. Забарвлення, пов’язане із спектрами перенесення заряду | |
| ІV. Забарвлення, пов’язане із спектрами кристалічного поля, тобто переходами між розщепленими d-рівнями | |
| V. Забарвлення, зумовлене переходами між рівнями f-електронів рідкісних земель і актиноїдів | |
| VI. Забарвлення, пов’язане із електронно-дірковими центрами, молекулярними іонами, вільними радикалами |
Рис. 11.33. Типи ідіохроматичного забарвлення мінералів і їх характеристичні
спектри поглинання (за Марфуніним)
Позиції в структурі мінералу, що спричинюють появу відповідних енергетичних рівнів, перехід між якими призводить до селективної абсорбції світла називаються кольоропоглинаючими центрами. Іони або групи іонів, що заселяють ці позиції і викликають вибіркову абсорбцію (поглинання) світла із певною довжиною хвилі називаються хромофорами.
Хромофорами є іони перехідних металів, рідкісноземельних елементів, деяких актиноїдів, а також вільні радикали та іони, входження яких в структуру викликає формування електронно-діркових центрів. Перелік поширених в мінералах хромофорів наведений в таблиці 11.8.
Таблиця 11.8. Поширені хромофори в мінералах
| Катіони перехідних металів | Катіони рідкісно-земельних металів і актиноїдів | Комплексні радикали-прекурсори електронно-діркових центрів | Катіони-прекурсори електронно-діркових центрів |
| Fe2+, Fe3+, Cr3+ | Ce3+, | O2-, S2-, F2- | Ti4+, V5+, Y3+, |
| Mn2+, Mn3+, Mn5+ | U4+, U3+, U2+ | SO4-, SO3- | Al3+, Fe3+, Zr4+ |
| V3+, V4+ | CO3-, CO- | Pb2+, Nb5+ | |
| Ni2+, Co2+, Cu2+ | Sm3+, Yb3+ |
Варто пам’ятати, що причиною виникнення забарвлення є не іон-хромофор сам по собі, а певна електронна конфігурація його зовнішніх оболонок, яка створює можливість реалізації одного чи декількох механізмів селективного поглинання світла у видимому діапазоні спектру електромагнітного випромінювання, які описані у розділі 11.5.
Відповідно, за домінуючим механізмом селективного поглинання, виділяться шість типів ідіохроматичного забарвлення.
Ідіохроматичне забарвлення І типу, що спостерігається у відбитому світлі і пов’язане із поглинанням, викликаним міжзонними переходами, за умови, що спектр власного поглинання перекриває видиму область. Таку природу має забарвлення непрозорих мінералів із зеркальним відбиттям (металічним блиском). Колір таких мінералів ми бачимо у відбитому світлі. У видимій області спектр відбиття таких мінералів має вигляд слабо нахилених або вигнутих кривих, із широкими пологими гребнями, що незначно виділяються на фоні загального відбиття.
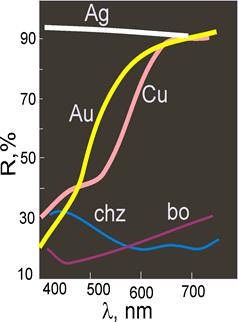
Рис. 11.34. Спектри відбитого світла від поверхні непрозорих мінералів. R – показник відбиття (співвідношення інтенсивності відбитого променя до інтенсивності початкового променя).
Ag - самородне срібло; Au - самородне золото; Cu – самородна мідь; chz – халькозин; bo - борніт
Зверніть увагу на відсутність селективного поглинання світла сріблом і виразну абсорбцію синьої, високоенергетичної частини спектру у золота, міді та борніту. Зміщення спектру відбиття в сторону червоного кінця спектру в міді зумовлює рожево-червоне забарвлення міді, в порівнянні із жовто-оранжевим – для самородного золота.
Більшість непрозорих мінералів не має забарвлення. Вони є білими (самородне срібло), світло-сірими (арсенопірит, галеніт, молібденіт) або сірими (бляклі руди, буладжерит). Зростання сірості пропорційне збільшенню поглинання. На білому або сірому фоні виділяються слабкі відтінки, залежно від нахилу видимої частини спектру відбиття (рис. 11.34). Тут варто відмітити, що спостереження забарвлення непрозорих мінералів варто проводити на свіжому сколі або ж (коректніше) – на полірованій поверхні мінералу. Непрозорі мінерали легко окиснюються і, вже через короткий час, їх зовнішній вигляд визначається забарвленням окисної плівки на поверхні мінералу та оптичними ефектами, спричиненими цією плівкою, тобто забарвлення, яке ми спостерігаємо в такому випадку, є псевдохроматичним. Таку природу має коричнюватий відтінок замородного заліза чи платини, цегляно-червоний колір самородної міді, оранжево-жовтий колір халькопіриту, жовтий дочервонувато-жовтого колір піриту, фіолетовий до синього колір борніту (порівняйте із ідіохроматичним забарвленням цих мінералів у відбитому світлі, наведеним в табл. 11.9).
Рожево-червоний колір міді зумовлений тим, що відбиття світла здійснюється в довгохвильовій – червоній і жовтій – частині спектру (90% відбиття при довжинах більше 630 нм), а короткохвильове випромінювання (менше 550 нм) поглинається (відбиття менше 50%). Зниження відбивної здатності пов’язане із смугою поглинання при ~ 16 900 см-1, що викликана електронним переходом із 3d-смуги валентної зони в зону провідності, точніше, на рівень Фермі, а також абсорбцією світла в районі 20 000 см-1, пов’язаною із переходом електронів 3d104sà 3d94s2.
Жовтий колір мінералів зумовлений зменшенням відбивної здатності із зменшенням довжини хвилі у видимому спектральному діапазоні. Дуже тонкі плівки золота виявляють в проходячому світлі синьо-зелене забарвлення, що зумовлено абсорбцією в червоному діапазоні, пов’язаною із переходом 5d106sà 5d96s2.
Таблиця 11.11. Забарвлення у відбитому світлі деяких непрозорих мінералів
| Мінерал | Забарвлення |
| Халькозин | голубий |
| Ковелін | синій |
| Нікелін | Рожевий |
| Самородний бісмут | Світло-рожевий |
| Самородна мідь | Рожево-червоний |
| Піротин | Бронзовий (рожево-коричневий) |
| Борніт | Фіолетово-рожевий |
| Пірит | Білий із жовтим відтінком |
| Халькопірит | Жовтий із зеленим відтінком |
| Самородне золото | Жовто-оранжевий |
| Станін | Зелено-коричневий (”хакі”) |
| Талнахіт | Яскраво-жовтий |
| Пентландит | Жовто-рожевий |
| Кобальтин | Білий із рожевим відтінком |
Висновок:
Ідіохроматичне забарвлення ІІ типупов’язане із поглинанням, викликаним міжзонними переходами, забарвлення, за умови, що край власного поглинання попадає у видиму область.Таке забарвлення проявляється у мінералів, ширина забороненої зони яких відповідає енергії видимої частини спектру (~ 3.0 – 1.6 еВ) (табл. 11.9). Край власного поглинання відрізає частини спектру, прилеглі до ультрафіолетової області, що зумовлює яскраве та чисте забарвлення: жовте у грінокіту (ширина забороненої зони 2.41 еВ або 514.4 нм), ауріпігменту (2.5 еВ, 496 нм), оранжеве реальгару, червоне в кіноварі (~600нм), сульфосолей срібла (пруститу, піраргіриту, пірсеїту).
Кристали мінералів із проміжним значенням ширини забороненої зони вибірково абсорбують світло, створюючи виразне забарвлення пропущеного світла. Так прустит Ag3[AsS3], що має Dзабор.~2еВ, поглинає все видиме світло, за винятком найбільш довгохвильового червоного, що і створює виразне червоне забарвлення мінералу. В гринокіті (Dзабор.~2.5 еВ) поглинаються лише сині і фіолетові промені, в результаті чого мінерал забарвлюється в жовтий колір.
Ширина забороненої зони може змінюватися в ряду твердих розчинів, що спричинює зміну колірності і світлості забарвлення мінералів. Хорошим прикладом цього є сфалерит ZnS, що, згідно із шириною забороненої зони (3.6–3.9 еВ), є безбарвним, при відсутності домішок заліза. В ряду твердих розчинів (Zn,Fe)S, сфалерит змінює колір від жовтого (<1% Fe) через коричневий (2-8 % Fe) до чорного (>8 % Fe). Зростання вмісту заліза призводить до розширення смуги поглинання із початково фіолетової області до червоної і до повного поглинання видимого світла. Входження Fe2+ в структуру сфалериту призводить до появи додаткових донорних або акцепторних рівнів, що відповідно, можуть захоплювати дирки, що утворються при взаємодії кристалічної структури із фотонами (Fe2+↔Fe3+), або ж захоплювати фотоелектрони (Fe2+↔Fe+). Завдяки цьому механізму, домішки Fe2+ «гасять», не дають можливості проявитися, інші акцепторні та донорні домішки.
Таблиця 11.11. Забарвлення прозорих і напівпрозорих мінералів, зумовлене шириною забороненої зони
| Мінерал | Ширина забороненої зони, еВ | Забарвлення |
| Діамант C | 5,4 | Безбарвний |
| Сфалерит ZnS | 3,64 | Безбарвний |
| Цинкіт ZnO | 3,0 | Безбарвний |
| Грінокіт CdS | 2,6 | Жовтий |
| Аурипігмент As2S3 | 2,46 | Жовтий |
| Реальгар As4S4 | 2,32 | Оранжевий |
| Se-грінокіт CdS1-xSex | 2,3 | Оранжевий |
| Куприт Cu2O | 2,0 | Червоний |
| Кіновар α–HgS | 2,0 | Червоний |
| Піраргірит Ag3SbS3 | 1,9 | Густо-червоний |
| Метацинабарит β–HgS | 1,6 | Непрозорий , пропускає інфрачервоні промені |
| Пірит FeS2 | 0,9 | Непрозорий, пропускає інфрачервоні промені |
| Галеніт | 0,4 | Непрозорий у видимій і ближній інфрачервоній частині спектру |
Зменшення ширини забороненої зони і відповідне виразне почервоніння забарвлення спостерігається при зростанні вмісту Cd у твердому розчині (Zn,Cd)S. Збагачені кадмієм сфалерити (при відсутності Fe) мають яскраве оранжево-червоне чи густо-червоне забарвлення.
Іншим прикладом може слугувати грінокіт CdS, що, в чистому вигляді, має ширину забороненої зони 2.6 eV і жовте забарвлення. У твердому розчині із CdSe (Eg = 1 .6 eV), зростання вмісту селенового фіналу супроводжується зменшенням ширини забороненої зони, що призводить до зміни забарвлення в ряду жовте –оранжеве – червоне – темно-червоне. Крайні селенові члени цього ряду є непрозорими.
Ширина забороненої зони залежить від кристалічної структури. Саме цим зумовлена разюча відмінність у забарвленні двох поліморфів HgS. Кіновар α–HgS має Eg = 2.0 eV і має густо-червоне забарвлення, тоді як метацинабарит β–HgS із Eg = 1.6 eV є непрозорим: чорним.
Важливу роль у формуванні забарвлення у цьому випадку можуть відігравати донорні і акцепторні домішки у мінералах-напівпровідниках. Це можна продемонструвати на прикладі сфалериту (Платонов, Марфунин, 1968) (див. рис. 11.19). Фундаментальне поглинання припадає на ультрафіолетову область: край смуги поглинання 29000 см-1, що відповідає ширині забороненої зони в 3.64 еВ. При відсутності в складі сфалериту заліза та мангану проявляється ефект інших кольоротвірних акцепторних та донорних домішок: зелений колір виникає при входженні в структуру Co2+, червоний і оранжевий - невеликими домішками Ag+, In3+, Sn4+.
Входження донорної домішки азоту в структуру алмазу приводить до формування донорного рівня в 4 еВ нижче дна зони провідності. Під впливом складного комплексу факторів (в тому числі, теплових коливань) розширюється до смуги. Кванти світла із енергією більш ніж 2.2 еВ можуть викидувавати електрони із цієї смуги в зону провідності, що зумовлює поглинання частини короткохвильового спектру і формування слабкого світло-жовтого забарвлення (при концентраціях 1 атом N на 100 000 атомів С). При вмісті азоту на рівні 1 на 1000 атомів вуглецю, алмази набувають буже рідкісного зеленого забарвлення. При ще більших вмістах азоту донорний рівень розширюється настільки, що перекривається із зоною провідності і алмаз повністю поглинає світло, стає чорним.
Бор, що має на 1 електрон менше, порівняно із вуглецем, утворює акцепторний рівень на 0.4 еВ нижче рівня Фермі. Дірки, що формують акцепторний рівень можуть приймати електрони, збуджені низькоенергетичними квантами світла, із різних рівнів зони валентності.. Концентрація бору в кількості 1 на 1 млн. атомів вуглецю спричинює появу синього забарвлення в алмазу. Алмази із таким забарвленням є дуже рідкісними і високо ціняться на ювелірному ринку.
Висновок:
Ідіохроматичне забарвлення ІІІ типу– забарвлення, пов’язане із спектрами перенесення заряду,. Спектри перенесення заряду спостерігаються для всіх іонів перехідних металів, в тому числі тих, що не дають спектрів кристалічного поля, але для більшості із них смуга поглинання знаходиться в ультрафіолетовому діапазоні і не впливає на забарвлення.
В мінералах, що містять у своєму складі перехідні метали, реалізуються два механізми перенесення заряду, що можуть спричинювати смуги поглинання у видимосу світловому діапазоні:
1. Перенесення заряду в парі іон металу – ліганд (переважно кисень) , тобто із переходами електронів із зв’язуючих молекулярних орбіталей на антизв’язуючі незаповнені орбіталі.
2. Перенесення заряду між різновалентними катіонами, що знаходяться в структурних позиціях, сприятливих для такого перенесення (такими як тісний зв’язок між координаційними поліедрами обох іонів, наявність незв’язуючих орбіталей, що перекриваються).
Забарвлення, пов’язане із спектрами перенесення заряду в парі перехідний метал – ліганд, характерне для оксидів та оксисолей, що містять перехідні метали із високими ступенями окиснення Fe3+, Ti4+, Cr6+, V5+, Mn4+. Поглинання за цим механізмом припадає на коротко-хвильову частину спектру, формуючи край короткохвильового поглинання на спектрі. Це спричинює зміщення забарвлення в червону область.
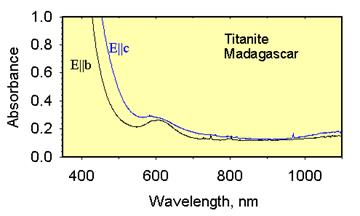
| 
|
| Рис. 11.35. Спектр поглинання титаніту. Смуга поглинання в короткохвильовій частині (420-480 нм) зумовлена перенесенням заряду Ti4+↔O2-. |
Різні відтінки від жовтого до коричневого кольору у мінералів виникають в результаті короткохвильового поглинання світла при переносі заряду в парі Ti4+↔O2- у титаніту, андалузиту, лампрофіліту, евдіаліту, гумітів, клінтоніту. Чому це не виникає в рутилу Зсув короткохвильового краю поглинання в довгохвильову область порівняти спектри рутилу (рис. )і титаніту
Зсув короткохвильового краю поглинання в довгохвильову область викликає забарвлення мінералу різними відтінками червоного кольору. Саме такий механізм виникнення забарвлення, спричинений перенесенням заряду в парі Fe3+↔O2-, коли Fe3+ знаходиться в октаедричній координації, характерний для оксидів заліза. Він є причиною червоного кольору гематиту, рудо-бурого кольору ґетиту, рудо-червоного кольору лепідокрокіту, Відмінність у забарвленні для вказаних випадків зумовлена різним оточенням іону Fe3+ (порівняйте координаційні поліедри FeO6 у гематиту і FeO4(OH)2 у ґетиту), різною його локальною симетрією (ґетит і лепідокрокіт).
Ускладнення структури призведе до зміни енергії перенесення заряду. Так, у шпінелях, входження Fe3+ в октаедричну позицію структури спричинює перенесення заряду Fe3+↔O2- і поглинання довгохвильової чистини спектру, викликаючи фіолетове забарвлення мінералу.
Перенесення заряду Fe3+↔O2-, зумовлене входженням Fe3+ в тетраедричну позицію берилію в структурі берилу викликає смугу поглинання 12300 см-1, що разом із смугою поглинання в короткохвильовому діапазоні, пов’язаній із перенесенням заряду Fe63+↔O2-, зумовлює жовте забарвлення берилу – геліодору.
Забарвлення, пов’язане із спектрами перенесення заряду в уранільній групі U6+O22+ є виразною ознакою багатьох мінералів урану. Їх насичене яскраве зелене, жовте та оранжеве забарвлення є чудовою діагностичною ознакою, своєрідним вказівником радіоактивної небезпеки. Уранільна група UO22+ – це лінійний іон O–U–O, що входить як структурна одиниця в склад багатьох фосфатів та ванадатів, зокрема уранових слюдок, таких як жовто-зелений отеніт Ca{(UO2)2(H2O)10[PO4]2, зелений торбеніт Cu{(UO2)2(H2O)10[PO4]2, жовтий або зелений тюямуніт Ca{(UO2)2[V2O8]2}·8H2O.
Молекулярна орбіталі уранілу формується із 12 валентних електронів (шість електронів U 5f36d17s2 і по чотири електрони двох атомів O 2p4, за винятком двох електронів, що створюють двохвалентний стан UO22+). Вони розміщуються на чотирьох зв’язуючих молекулярних орбіталях (рис. 9,36а). Чотири f–орбіталі (по дві δu і Fu) і дві d–орбіталі (δg) є тут незв’язуючими. Збуджені конфігурації виникають при перенесенні електрону із останньої зайнятої МО (1πg)4 на перші вільні МО – δu і Fu, що додатково розщеплюються на підрівні внаслідок взаємодії із коливаннями молекули в цілому. Відповідно, дві широкі смуги перенесення заряду в ультрафіолетовому і синьому діапазоні розпадаються на серію смуг коливних переходів. Так звана флюорисцентна серія смуг знаходиться у видимому діапазоні (455-500 нм). Структура спектру поглинання ураніл-містного мінералу залежить від координаційного оточення групи UO22+, яке сильно різниться в різних мінералів (рис. 11.36б). Це зумовлює значні варіації прояву окремих вузьких смуг поглинання і варіації забарвлення між жовтим і зеленим із високою чистотою колірного тону. Відсутність диференціації смуг у серії призводить до рівномірного поглинання фіолетової та синьої частини спектру і формування оранжевого забарвлення.
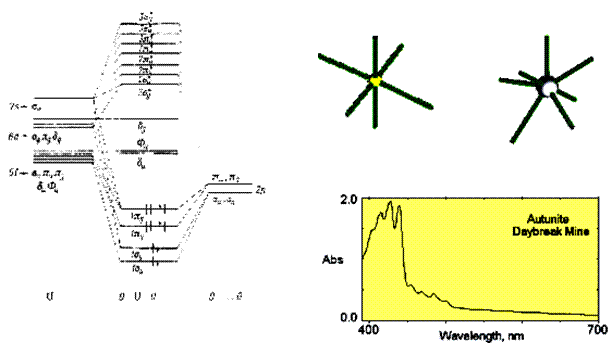
| ||
 отеніт отеніт
|  торбеніт
торбеніт
|  кюріт кюріт
|
| Рис. 11.36. Спектр поглинання отеніту. Смуга поглинання в короткохвильовій частині (420-480 нм) зумовлена перенесенням заряду U6+↔O2-. from the Daybreak Mine near Spokane, Washington, USA |
Рідкісним випадком у мінералах є перенесення заряду Mn5+ ↔ O2- . Відповідні смуги поглинання спостерігається на спектрах синіх апатитів, в яких комплекси MnO43+ заміщують фосфатну групу.
Забарвлення, пов’язане із перенесенням заряду між різновалентними іонами, що знаходяться в структурних позиціях, взаємне розміщення яких сприяє такому перенесенню.
Яскравим прикладом такого механізму є формування синього забарвлення корунду – сапфіру, що виникає при ізоморфному заміщенні за схемою 2Al3+→ Ti4+ + Fe2+. Перенесення заряду в парі Ti4+ ↔ Fe2+ викликає абсорбцію червоної частини спектру, зумовлюючи синій колір мінералу. (детальний опис поглинання за цим механізмом дивіться в розділі 11.5.5 ).
Таблиця 11.10. Причини ідіохроматичного забарвлення мінералів (за Нассау, 1978, із доповненнями)Перенесення заряду в об'єднаних молекулярних орбіталях
| Fe2+ óFe3+ | Магнетит | Чорний | |
| кордієрит (Йоліт) | Синьо-фіолетовий | ||
| кіаніт | синій | ||
| Вівіаніт | Блакитний, зелений | ||
| Берил (аквамарин) | Зеленувато-блакитний | ||
| Fe2+ óTi4+ | Корунд (сапфір) | (Al, Fe2+,Ti4+)2O3 | синій |
| сапфірин | (Mg,Al,Fe2+,Ti4+))8(Al,Si)6O20 | Синій, блакитний | |
| Кіаніт | (Al, Fe2+,Ti4+)2O[SiO4] | Синій, блакитний | |
| мусковіт | |||
| Тремоліт і інші амфіболи | |||
| Елбаїт і інші турмаліни | |||
| Бенітоїт | синій | ||
| Нептуніт | Червоно-оранжевий до чорного | ||
| Дравіт | Жовто-коричневий | ||
| Mn2+óTi4+ | Елбаїт | Жовтий до коричневого | |
| Ti4+óO2- | Титаніт | коричневий | |
| Ставроліт | коричневий | ||
| Гуміт | коричневий | ||
| Fe3+óO2- | Ґетит | коричневий | |
| Гематит | вишнево-червоний | ||
| Берил (геліодор) | Жовтий | ||
| Cr6+óO2- | Крокоїт | оранжевий | |
| V5+óO2- | Ванадиніт | оранжевий | |
| V4+ óO2+ | кавансит | Ca[Si4O10½VO]· 4H2O | |
| V4+ óO2+ | Апофіліт | (Na,K)[(Si,V)4O10]2(OH,F) ·8H2O | |
| Mn5+ ↔ O2- | апатит | синій | |
| U6+ óO2+ | отеніт | Яскраво-жовтий | |
| Торбеніт | Яскраво-зелений | ||
| Шарпіт | (UO2)[CO3] ·H2O | Зелено-жовтий | |
| Бекереліт | 6(UO2)(OH)2·Ca(OH)2·4H2O | Жовтий | |
| Кюрит | 3PbO·8UO3·4H2O | Помаранчево-оранжевий | |
| As3-óS2- | Аурипігмент | Жовтий | |
| Реальгар | оранжевий |
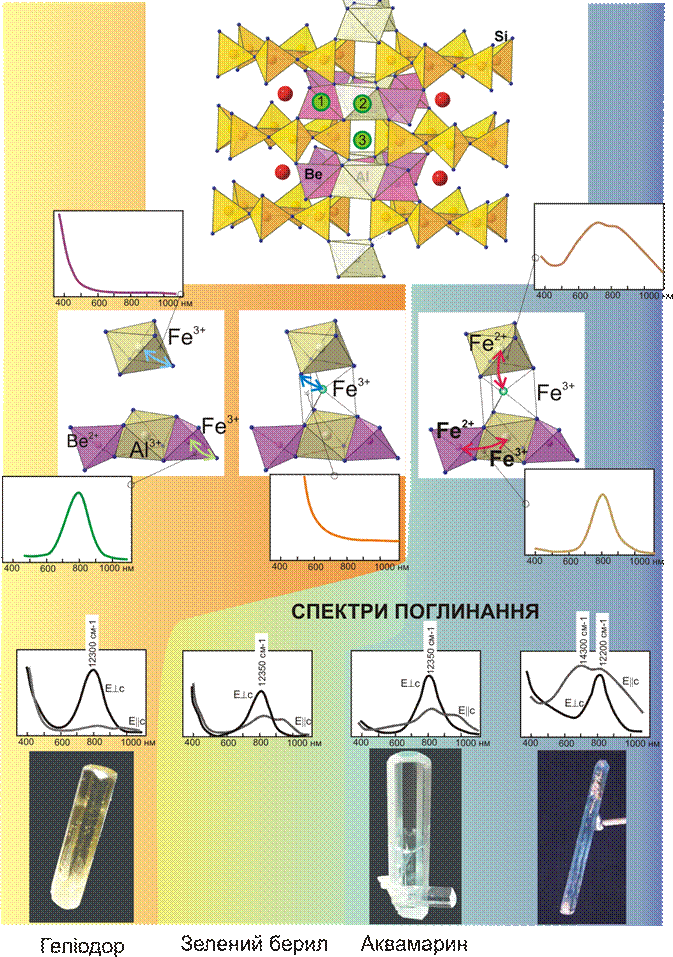
Рис. 11.37. Природа геліодорового і аквамаринового забарвлення берилу. Зверху показана структура берилу і три можливих позиції входження в неї іонів заліза (детальніше в тексті).
Середній ряд показує можливі варіанти заміщення Be2+ і Al3+ на Fe2+ і Fe3+ і схеми перенесення заряду, що реалізуються при цьому. також зображені спектри поглинання, що відповідають кожній із схем.
Дата добавления: 2015-05-21; просмотров: 2528;
