Атомні спектри
Якщо атом не зазнає зовнішніх впливів (зіткнень з іншими атомами, опромінення тощо), то він знаходиться у стані з мінімальною енергією - в основному енергетичному стані. Зміна енергетичного стану атомів при зовнішніх впливах зумовлена зміною їх електронних конфігурацій, тобто переходами електронів між різними енергетичними рівнями. Довжини хвиль або частоти, що їх випромінюють або поглинають атоми при таких переходах, характеризують спектри випромінювання та поглинання відповідно.
Спектри випромінювання та поглинання вільних або слабо взаємодіючих атомів, зумовлені переходами між енергетичними рівнями зовнішніх (валентних) електронів, називаються оптичними атомними спектрами. Закономірності, притаманні атомним спектрам, розглянемо на прикладі спектра випромінювання атомів водню.
У результаті розв'язку рівняння Шредінгера були одержані можливі значення енергії атома водню
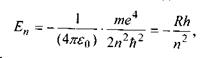
де 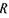 - стала Рідберга;
- стала Рідберга; 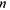 - головне квантове число.
- головне квантове число.
Діаграму енергетичних рівнів атома водню, розраховану за одержаною формулою, подано на рис. 7.1.
Надання атому енергії, як наслідок зовнішнього впливу, спричинює його до збудженого стану, що відповідає переходу електрона з основного на більш високий енергетичний рівень (на більш високоенергетичну орбіталь)
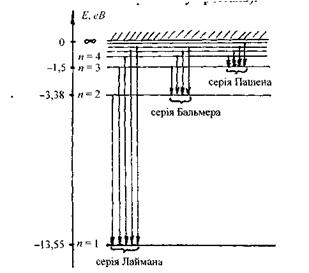
Рис. 7.1. Діаграма енергетичних рівнів атома водню.
Через проміжок часу 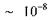 с (час життя атома в збудженому стані) атом повертається в основний енергетичний стан, випромінюючи такі частоти:
с (час життя атома в збудженому стані) атом повертається в основний енергетичний стан, випромінюючи такі частоти:
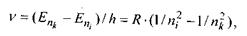 (7.14)
(7.14)
де 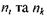 - головні квантові числа енергетичних рівнів, між якими відбувається перехід, причому
- головні квантові числа енергетичних рівнів, між якими відбувається перехід, причому 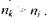
Одержана формула не тільки пояснює встановлений експериментально лінійчастий характер атомних спектрів, а й дає змогу розрахувати набір частот, які відповідають спектральним лініям, що спостерігаються.
Спектр випромінювання атома водню складається з окремих груп ліній, які називаються спектральними серіями. Кожній серії відповідає набір частот, що випромінюється атомами при переході електрона на певний енергетичний рівень з усіх вищерозташованих рівнів (рис. 7.1).
При переході електрона на основний енергетичний рівень 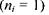 з усіх інших рівнів
з усіх інших рівнів 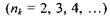 випромінюється серія Наймана, що лежить в ультрафіолетовій області. Частоти, які відповідають спектральним лініям цієї серії, легко одержати із узагальненої формули (7.14) за умови
випромінюється серія Наймана, що лежить в ультрафіолетовій області. Частоти, які відповідають спектральним лініям цієї серії, легко одержати із узагальненої формули (7.14) за умови
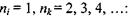
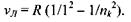
При переході електрона на основний енергетичний рівень з головним квантовим числом 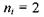 з більш високо розташованих рівнів випромінюється серія Бальмера, що лежить у видимій та ближній ультрафіолетовій областях:
з більш високо розташованих рівнів випромінюється серія Бальмера, що лежить у видимій та ближній ультрафіолетовій областях:
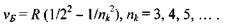
При переході збудженого електрона на рівень, що характеризується головним квантовим числом 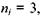 з усіх вище розташованих рівнів випромінюється серія Пашена, яка лежить в інфрачервоній області:
з усіх вище розташованих рівнів випромінюється серія Пашена, яка лежить в інфрачервоній області:
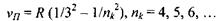
Слід відзначити, що в кожній серії відстань між лініями зменшується при переході до більш коротких хвиль. При цьому кожна серія має короткохвильову границю, за межі якої вона не виходить. Ця границя називається "граничною лінією" серії, її частота визначається по узагальненій формулі (7.14) при умові 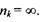
Атомні оптичні спектри багатоелектронних атомів складніші за спектри атома водню, але їм теж притаманні розглянуті вище закономірності.
Дата добавления: 2015-06-22; просмотров: 2145;
