ФІЗИКО-ХІМІЧНІ|фізико-хімічні| ОСНОВИ ІОННОГО ОБМІНУ
Вода, що пройшла передочищення, практично не містить|утримує| в собі грубодисперсних домішок|нечистот| і в значній мірі|значною мірою| звільнена|визволяти| від колоїдних. Проте|однак| основна частина|частина| домішок|нечистот| в істинно-розчиненому стані|достатку| залишається в цій воді і має бути видалена|віддалена| з|із| неї. В наш час|нині| для цього застосовують іонний обмін, а також мембранні і термічні методи. Останній метод для отримання|здобуття| води необхідної якості найчастіше використовують в комплексі з|із| іонним обміном.
Сутьність|єство| іонного обміну полягає у використанні здатності|здібності| деяких спеціальних матеріалів (іонітів) змінювати|зраджувати| в бажаному напрямі|направленні| іонний склад домішок|нечистот| води. Процес іонного обміну істотно|суттєвий| відрізняється від процесу адсорбції тим, що якщо при адсорбції відбувається|походить| лише накопичення речовини, що сорбується з|із| розчину на поверхні якого-небудь матеріалу, то при іонному обміні сорбція з|із| розчину іонів одного виду|виду| обов'язково супроводжується переходом раніше сорбованих іонів іншого виду|виду| в розчин. Таким чином, при іонному обміні іони одного виду|виду| замінюються іонами іншого.
Здібність іонітів до іонного обміну пояснюється|тлумачить| їх будовою|спорудою|. Будь-який іоніт складається з твердої основи (матриці|), на яку тим або іншим способом нанесені|завдавати| спеціальні функціональні групи, здатні|здібні| при приміщенні|помешканні| іоніту в розчин до утворення на поверхні іоніту потенціалутворюючих| іонів, тобто до виникнення заряду. Внаслідок цього навколо|навколо| твердої фази створюється дифузний шар з|із| протилежно заряджених іонів (протиіонів|). Поява потенціалутворюючих| іонів може| відбуватися|походити| або за рахунок адсорбції функціональними групами іоніту з розчину іонів якого-небудь знаку заряду (наприклад, – NH3 + H+ → – NH4 ), або дисоціації функціональних груп під дією молекул води (наприклад, – SO3H → – SO3– + H+ ). У останньому випадку протиіонами, що створюють дифузний шар, є іони, що переходять в розчин в процесі дисоціації. Іони дифузного шару володіють підвищеним запасом кінетичної енергії і можуть виходити з дифузного шару в розчин, але при цьому з розчину в дифузний шар повинні переходити іони того ж знаку заряду. Таким чином, іоніт можна представити як твердий електроліт, нерухома частина якого представляє одну його частину, а рухливі протиіони – іншу (рис. 3.1). Отже, реакції іонного обміну підкоряються правилам, характерним для реакцій звичайних електролітів, зокрема правилам еквівалентності обміну іонів і оборотності цього процесу. Крім того, при іонному обміні велике значення мають селективність і швидкість встановлення іонообмінної рівноваги.
Еквівалентність обміну іонів полягає в тому, що пониження концентрації якого-небудь іону в розчині в результаті протікання іонообмінного процесу викликає еквівалентне підвищення концентрації іншого іону, що поступає в розчин з іоніту. Відступи від цього закону в деяких випадках пояснюються вторинними реакціями, в які вступають перехідні в розчин іони. Так, наприклад, якщо в результаті обміну іонів в
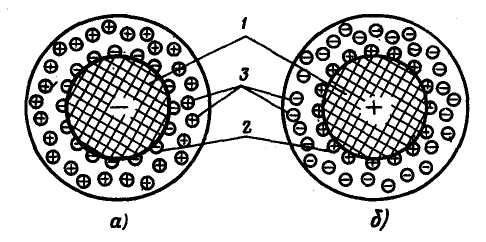
Рис. 3.1. Схема структури зерна іоніту:
а – катіоніт; б – аніоніт; 1 – матриця; 2 – потенціалутворюючі іони; 3 – іони дифузного шару
розчин потрапляють іони Н+, то вони можуть реагувати з іонами HCO3– з утворенням СО2. При цьому концентрація іонів Н+ у розчині знижується і створюється враження нееквівалентності обміну іонів.
Оборотність процесу обміну іонів є однією з найважливіших закономірностей, що дозволяють економічно використовувати іонообмінний матеріал в технологічних схемах. Переважний напрямок реакції іонного обміну визначається згідно закону діючих речовин. При виснаженні іоніту можна, підвищивши в розчині концентрацію первинних обмінних іонів, зрушити реакцію іонного обміну у напрямі відновлення іоніту в початковий стан, тобто провести регенерацію іоніту.
Рівновага в системі іоніт – розчин електроліту описується законом Нікольського
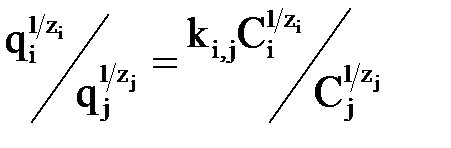 , ,
| (3.1) |
де q і С – концентраціїіонів i та j, що обмінюються, відповідно в іоніті і розчині, г-екв/кг і г-екв/м3;
ki, j – коефіцієнт рівноваги іонного обміну,  ,
, 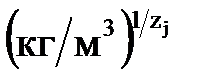 ; zі і zj – валентності іонів, що обмінюються.
; zі і zj – валентності іонів, що обмінюються.
Щоб ліва частина цього рівняння дорівнювала нулю, необхідно, щоб Сі і Сj дорівнювали нулю, що при іонному обміні неможливе. Отже, навіть в рівноважному стані неможливе положення, при якому обмінні іони можуть бути повністю витиснені в розчин і замінені іонами іншого виду.
Якщо в іоніті і розчині одночасно знаходяться іони видів А і В, то, прийнявши співвідношення їх концентрацій в розчині т = СА/СВ,а в іоніті n = qA/qB, в загальному випадку можна записати, що т ≷п. Якщо п > т, то іон А краще сорбується іонітом, ніж іон В, якщо п < т, то навпаки. Це говорить про те, що природа іона грає важливу роль в процесі його сорбції іонітом. Здібність іоніту до переважної сорбції одних видів іонів в порівнянні з іншими називається селективністю. Вона кількісно може бути виражена через коефіцієнт селективності
| ТА/В = qB СВ / qB CA. | (3.2) |
Коефіцієнт селективності зазвичай|звично| визначається експериментально| на підставі побудови|шикування| ізотерм адсорбції іонітом| іонів даного виду|виду|.
Селективність, як буде показано нижче, грає дуже велику роль в технології іонного обміну. Фізико-хімічна сутьність селективності при іонному обміні витікає із закону Кулона. Ясно, що із збільшенням заряду (валентності) іона зростає і сила його тяжіння до іоніту. Якщо представити заряд іона сконцентрованим в його центрі, то за відстань від цього заряду до поверхні іоніту можна прийняти радіус іона. В межах кожної основної підгрупи періодичної системи елементів радіуси іонів зростають із збільшенням атомної маси елементів. Проте при цьому зменшується щільність заряду іонів, а отже, і ступінь їх гідратації. Гідратна оболонка, що складається принаймні з двох шарів молекул води довкола іона, збільшує радіус цього іона. Так, наприклад, ефективні радіуси іонів Na+ і К+ у 0,1 н. розчинах складають відповідно 9,8 і 13,3 нм. Проте зміна щільності заряду приводить до того, що гідратні оболонки цих іонів відповідно складаються з 8,6 і 4,2 молекул води. Тому гідратований радіус іонів Na+>K+. З урахуванням цього в межах кожної основної підгрупи періодичної системи радіуси іонів в гідратованому стані зменшуватимуться із збільшенням атомної маси елементів і, отже, збільшуватиметься сила їх тяжіння до поверхні іоніту. Селективність іонів при іонному обміні представляється зазвичай у вигляді рядів селективності:
для катіонів на сильнокислотному катіоніті
| Н+ < Na+ < NH4+ < Mg2+ < Са2+ < Аl3+; | (3.3) |
для аніонів на високоосновному аніоніті
| OH– < HSiO3 < HCO3– < Cl– <H2PO4– < NO3– <SO42–. | (3.4) |
Для слабокислотних катіонітів іон Н+, а для низькоосновних аніонітів іон ОН– переміщаються правіше залежно від ступеня дисоціації іонітів в процесі іонного обміну.
У динамічних умовах вода, що проходить через шар іоніту, контактує (по висоті шару) з новими для неї об'ємами іоніту. При цьому у верхньому шарі іоніту вода містить найбільшу концентрацію іонів, а іоніт – найменшу. Природно, що найбільша сорбція іонів спостерігатиметься саме у верхньому шарі іоніту. У воді, що поступає на верхні шари іоніту, концентрація іонів не змінюється, а в іоніті внаслідок іонообмінного процесу їх кількість збільшуватиметься. Таким чином, з часом іоніт в цій частині шару виснажуватиметься і процес сорбції пересунеться далі по шару. Очевидно, що концентрація іонів, що видаляються, поступають на якусь ділянку шару х у моментчасу τ1 і τ2, буде різною, причому якщо τ2 > τ1 то ΔС = Сτ2 – Cτ1 > 0. Гранично при якомусь τn Сτn = Cисх дляцієї ділянки. Це означає, що всі ділянки, розташовані вище цього, вже не здійснюють іонний обмін. З іншого боку, для розподілу концентрації іонів, що видаляються, по висоті фільтру для ділянок х1 і х2(причому х2 > х1) в деякий момент часу τ справедливо, що ΔС = Сх2 – Cх1 < 0, тобто концентрація іонів, що видаляються, падає по висоті шару. Безперервне зниження концентрації по висоті шару приводить до того, що їх концентрація на якійсь ділянці шару стає практично рівною нулю. Таким чином, при здійсненні іонного обміну шляхом фільтрування води через шар в останньому можна виділити три ділянки: відпрацьований, робочий і ще не працюючий. На межі між першою і другою ділянками розташовується зона початкової концентрації іонів, а на межі між другим і третім – зона їх нульової концентрації (рис. 3.2). У певний момент часу зона нульової концентрації досягає нижньої межі шару і відбувається проскакування іонів у фільтрат. Це зазвичай служить сигналом для
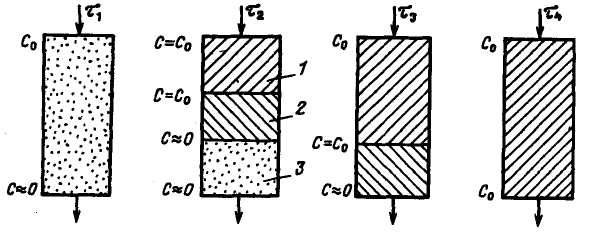
Рис. 3.2. Утворення зон при роботі іонітного фільтру:
1 – зона виснаженого іоніту; 2 – робоча зона; 3 – зона свіжого іоніту; τ1 – τ4 – час проходження води через фільтр
відключення фільтру на регенерацію. До цього часу обмінна ємність фільтру використана не повністю і очевидно, що на ступінь її використання впливатиме ширина робочої ділянки, тобто область між початковою і нульовою концентраціями іонів, що видаляються. Розподіл концентрацій на цій ділянці носить назву фронту фільтрування. Вид кривої фронту фільтрування може змінюватися при переміщенні його по шару. У загальному випадку справедливо, що 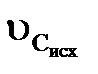 ≷
≷ 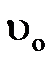 , де υ – швидкість переміщення обох зон. При
, де υ – швидкість переміщення обох зон. При 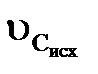 <
< 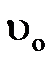 швидкість переміщення зони з нульовою концентрацією вища, ніж початкова, і робоча ділянка в процесі фільтрування розтягуватиметься, утворюючи дифузний фронт фільтрування (рис. 3.3). Якщо
швидкість переміщення зони з нульовою концентрацією вища, ніж початкова, і робоча ділянка в процесі фільтрування розтягуватиметься, утворюючи дифузний фронт фільтрування (рис. 3.3). Якщо 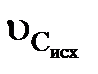 >
> 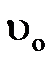 , то робоча ділянка шару стискуватиметься і
, то робоча ділянка шару стискуватиметься і
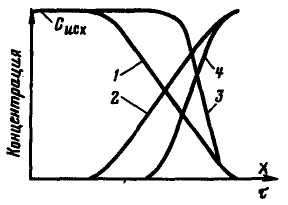
Рис. 3.3. Фронти фільтрування і вихідні криві в іонообмінних| фільтрах:
1 – дифузний фронт фільтрування; 2 – вихідна крива при дифузному фронті; 3 – гострий фронт фільтрування; 4 – вихідна крива при гострому фронті
утвориться гострий фронт фільтрування, який після формування перейде в стадію паралельного перенесення, коли 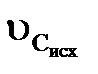 =
= 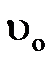 . Від виду кривої фронту фільтрування залежить ступінь використання обмінної ємності при роботі фільтру, тому при синтезі іоніти підбирають так, щоб сорбція найбільш важливих іонів у підготовці води відбувалася при гострому фронті фільтрування.
. Від виду кривої фронту фільтрування залежить ступінь використання обмінної ємності при роботі фільтру, тому при синтезі іоніти підбирають так, щоб сорбція найбільш важливих іонів у підготовці води відбувалася при гострому фронті фільтрування.
Дата добавления: 2015-05-19; просмотров: 1269;
